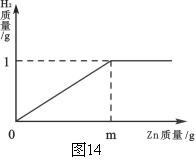
【题目】已知烧杯中装有200g硫酸和硫酸锌混合溶液,其中含硫酸锌12.1g。向烧杯中逐渐加入锌粒,放出气体质量与加入锌粒质量的关系如图14所示。当恰好完全反应时,所得的溶液为不饱和溶液。
请计算:
(1)m的值。
(2)原混合溶液中H2SO4的质量分数。
(3)恰好完全反应时,所得溶液中溶质的质量分数
【答案】
(1)32.5g
(2)24.5%
(3)40%
【解析】恰好完全反应时Zn 、H2SO4的质量分别为m 、x,生成ZnSO4的质量为y。
Zn + H2SO4 = ZnSO4+ H2↑·························1分
65 98 161 2
m x y 1g
(1)m=65×1g÷2=32.5g·························1分
x =98×1g÷2=49g·························0.5分
y=161×1g÷2=80.5g ·························0.5分
(2)H2SO4 的质量分数= ![]() ·························1分
·························1分
(3)恰好完全反应时,所得溶液中ZnSO4的质量分数为:
![]()

