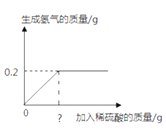
【题目】将20g黄铜(由铜、锌组成的合金)样品研磨成粉末,再加入10%的稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图。请计算:
(1)将黄铜研磨成粉末的目的是__________________.
(2)样品中铜的质量为___________?
(3)图中“?”处应标注的稀硫酸质量应为______________?
【答案】 增大反应物的接触面积,使反应更充分 13.5g 98g
【解析】(1)根据将黄铜研磨成粉末的目的是增大反应物的接触面积,使反应更充分解答;(2)(3)锌和稀硫酸反应生成硫酸锌和氢气,根据氢气的质量计算锌的质量,进一步计算铜的质量和反应的硫酸的质量,从而计算稀硫酸的质量。(1)将黄铜研磨成粉末的目的是增大反应物的接触面积,使反应更充分;
(2)由图可知,反应生成氢气的质量为0.2g。设锌的质量为x,反应的硫酸的质量为y。
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
![]()
x=6.5g
y=9.8g
样品中铜的质量为20g-6.5g=13.5g
(3)图中“?”处应标注的稀硫酸质量应为9.8g÷10%=98g
答:(2)样品中铜的质量为13.5g;(3)图中“?”处应标注的稀硫酸质量应为98g。

