【题目】某化学兴趣小组学习碱的性质后,到实验室做实验.小明将二氧化碳通入氢氧化钠溶液后无明显现象,然后向得到的溶液中滴加CaCl2溶液,产生白色沉淀;小杰做的实验和小明一样,但没有出现白色沉淀.他们为了查明原因,查阅资料:①CO2与NaOH反应的产物与反应物的量有关,少量CO2得到Na2CO3,过量CO2得到NaHCO3,反应的化学方程式:CO2+2NaOH=Na2CO3+H2O,Na2CO3+CO2+H2O=2NaHCO3;②Ca(HCO3)2溶于水,溶液呈碱性;③CaCl2溶液呈中性:④Na2CO3、NaHCO3溶液都呈碱性,都能与酸反应;⑤铝、锌、铁、铜的盐溶液与NaHCO3溶液混合会产生沉淀.
他们对CO2与NaOH溶液反应后,溶液中溶质是什么进行探究.
【猜想与假设】猜想①Na2CO3; 猜想②NaHCO3;
猜想③Na2CO3、NaOH; 猜想④_____________________.
【实验探究】
实验操作 | 实验现象 | 结论 |
(1)取适量反应后的溶液于试管中,加入适量的CaCl2溶液,振荡;再加入____. | 无明显现象;有气泡产生. | 猜想②成立,反应的化学方程式__________. |
(2)取适量反应后的溶液于试管中,加入过量的CaCl2溶液,振荡;过滤,取滤液于另一支试管中,滴加_________. | 产生白色沉淀;______. | 猜想③成立 |
【继续探究】将4.0gNaOH固体溶解在100mL水中,然后通入4.0g二氧化碳气体,充分反应后,所得溶液的溶质是___________.
参考答案:
【答案】 Na2CO3、NaOH、NaHCO3 稀盐酸 NaHCO3+HCl=NaCl+H2O+CO2↑ 无色酚酞试液 溶液变红 碳酸钠和碳酸氢钠
【解析】【猜想与假设】CO2与NaOH反应的产物与反应物的量有关,少量CO2得到Na2CO3,过量CO2得到NaHCO3,故猜想④应为Na2CO3、NaOH、NaHCO3的混合物;【实验探究】(1)碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,取适量反应后的溶液于试管中,加入适量的CaCl2溶液,振荡,无明显现象,说明不含碳酸钠;再加入稀盐酸,有气泡产生,说明含碳酸氢钠,则猜想②成立,碳酸氢钠能与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;(2)取适量反应后的溶液于试管中,加入过量的CaCl2溶液,振荡,产生白色沉淀,说明反应后的溶液中有碳酸钠;过滤,取滤液于另一支试管中,滴加无色酚酞试液,溶液变红,溶液呈碱性,说明反应后的溶液中有NaOH,猜想③成立;
【继续探究】设反应中消耗二氧化碳的质量为x。
2NaOH+CO2═Na2CO3+H2O
80 44
4g x
![]()
x=2.2g
二氧化碳过量,说明含有碳酸氢钠生成,充分反应后,所得溶液的溶质是碳酸钠和碳酸氢钠。
-
科目: 来源: 题型:
查看答案和解析>>【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量
剩余固体的质量
第一次加入10g
3.0g
第二次加入10g
2.0g
第三次加入10g
1.0g
第四次加入10g
0.6g
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图象能正确反映对应变化关系的是( )
A.
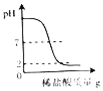 向一定量的氢氧化钠溶液中滴入pH=2的稀盐酸
向一定量的氢氧化钠溶液中滴入pH=2的稀盐酸B.
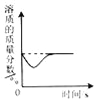 某温度时,向一定量的饱和石灰水中加入少量生石灰
某温度时,向一定量的饱和石灰水中加入少量生石灰C.
 向含有盐酸的氯化铜溶液中滴加烧碱溶液
向含有盐酸的氯化铜溶液中滴加烧碱溶液 D.
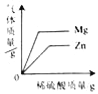 向等质量的镁、锌中,分别加入同浓度的稀硫酸
向等质量的镁、锌中,分别加入同浓度的稀硫酸 -
科目: 来源: 题型:
查看答案和解析>>【题目】硫原子的结构示意图及在元素周期表中的信息如图,从图中获得的信息不正确的是( )
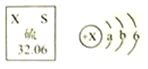
A. 在硫原子的核外电子排布中,a=2、b=8
B. 硫原子在化学反应中易得到2个电子变成S2﹣
C. 硫原子中,质子数=核外电子数=16
D. 硫元素在元素周期表中位于第六周期
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室部分仪器或装置如图所示,请回答下列问题.

(1)写出仪器名称:A_________、B__________.
(2)实验室常用石灰石和稀盐酸制取二氧化碳气体,发生装置可选择图中的________(填字母)进行组装,反应的化学方程式为_________________________.
(3)在制取过程中,小雨同学选用F装置收集二氧化碳,并用燃着的小木条放在瓶口验证二氧化碳是否收集满,发现小木条始终不熄灭,说明该瓶气体没有集满.出现上述现象的原因可能是(写一个):____________.
(4)在实验室中制取氧气,若用如图H所示装置采用“排空气法”收集氧气,请在图中将导管补画完整.__
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取混合物10g,放入一干净的烧杯中,然后取一定溶质质量分数的稀硫酸100g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次
第2次
第3次
第4次
第5次
加入稀硫酸的质量/g
20
20
20
20
20
生成气体的总质量/g
0.12
x
0.36
0.4
y
(l)上表中x=_______、y=_______.
(2)固体混合物中镁元素的质量分数为__________.
(3)所用稀硫酸的溶质质量分数为_____?
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~G是初中化学中常见的七种物质,其中A、B、C、E、F、G含有同一种元素,A、B、C、E、G是五种不同类别的物质;D和F在通常情况下为气体,两者分别溶于水后溶液的酸碱性相反.它们相互间的关系如图所示.(图中“﹣”表示相连的物质之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件己略去.)
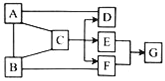
(1)G的化学式是____________.
(2)A与D反应符合绿色化学的原则,属于_______反应(填基本反应类型).
(3)C→D+E+F的化学方程式:____________________________.
(4)从微观的角度分析A与B能发生反应的原因是______________________.
相关试题

