【题目】某研究性学习小组设计了测定纯碱(Na2CO3)样品(假设只含NaCl杂质)中Na2CO3质量分数的实验方案,请你参与他们的探究活动,请回答下列问题:(不考虑原装置内空气的影响)
Ⅰ.A组同学设计了如图1的实验装置。

(1)实验时,在装药品前需组装好如图仪器,并_________。
(2)装置乙的作用是_________;
(3)装置丁的作用是_________。(填字母)
A.吸收Na2CO3与酸溶液反应产生CO2
B.防止空气中二氧化碳和水蒸气进入装置丙中
C.干燥二氧化碳
(4)实验中如果滴加酸溶液的速度过快,会导致测得样品中碳酸钠的质量分数____(填“偏大”或“偏小”或“无影响”)。
(5)B组同学认为A组同学的方案存在问题,即使操作规范,测定结果也会偏低,理由是_________,应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并在甲的左边连接上图2装置,实验结束后缓缓通入一段时间空气,目的是_________,其中NaOH溶液的作用是________。若没有图2装置,直接通入空气,则会导致测得结果_________(填“偏大”或“偏小”或“无影响”)。
(6)你认为实验时加入的酸溶液最好是_________(填“稀盐酸”或“稀硫酸”)。
Ⅱ.小明同学称取样品11.0g放入烧杯中,按如下实验方案进行实验。

(1)滤液Y中含有的溶质有_________(填写化学式)。
(2)证明CaCl2已过量的方法是_________(填写字母序号),然后观察现象判断。
A.静置悬浊液X,向上层清液中继续滴加少量氯化钙溶液
B.取少量滤液Y于试管中,滴加氯化钙溶液
(3)如果沉淀没有洗涤操作会造成碳酸钠质量分数________(填“偏大”或“偏小”或“无影响”)。
(4)通过以上提供的数据计算出样品中碳酸钠的质量分数为_________。(写出计算过程,结果保留至0.1%)
参考答案:
【答案】 检查装置气密性 除去CO2中水蒸气(或干燥CO2) B 偏小 有CO2残留在烧瓶内 将残留的CO2全部鼓入到丙装置中,使其完全被氢氧化钠溶液吸收 除去通入空气中的CO2 偏大 稀硫酸 CaCl2 、NaCl A 偏大 96.4%
【解析】Ⅰ.(1)制取气体时,首先检查装置的气密性;
(2)浓硫酸有吸水性,除去CO2中水蒸气,干燥CO2;
(3)丁中的碱石灰防止空气中二氧化碳和水蒸气进入装置丙中,影响计算;
(4)实验中滴加稀硫酸的速度过快,产生的气流过急,二氧化碳不能完全被氢氧化钠溶液吸收,导致测得样品中碳酸钠的质量分数偏低;
(5)由于A组同学的方案,反应完全后有CO2残留在烧瓶内,不能被装置丙中药品吸收,造成测得样品中碳酸钠的质量分数偏低;将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加图2装置,实验结束后缓缓通入一段时间空气,目的是将残留的CO2全部鼓入到并装置中,使其完全被氢氧化钠溶液吸收,其中NaOH溶液的作用是吸收空气中的CO2;直接通入空气,使得空气中的二氧化碳也被装置丙中药品吸收,则会导致测得结果偏大;
(6)由于盐酸具有挥发性,会发出的氯化氢气体,被装置丙中药品吸收,则会导致测得结果偏大,所以用稀硫酸;
Ⅱ.(1)纯碱样品只含NaCl杂质,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,由于氯化钙溶液过量,所以反应后所得液中含有CaCl2 、NaCl;
(2)CaCl2已过量,则溶液中不含碳酸钠,静置悬浊液X,向上层清液中继续滴加少量氯化钙溶液,不会产生白色沉淀,说明CaCl2已过量;
(3)因为在沉淀表面的可溶性杂质氯化钠,所以沉淀洗涤的目的是:除去沉淀表面的可溶性杂质;若不洗涤,杂质氯化钠的质量当作沉淀物的质量,即样品中所含的碳酸根偏大,导致碳酸钠的质量分数偏大;
(4)设样品中碳酸钠的质量是X
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
X 10.0g
![]()
X=10.6g
样品中碳酸钠的质量分数为![]() ×100%=93.4%。
×100%=93.4%。
答:样品中碳酸钠的质量分数为93.4%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作中,正确的是
A. 测定溶液pH
 B. 稀释浓硫酸
B. 稀释浓硫酸
C. 加热液体
 D. 称取氢氧化钠
D. 称取氢氧化钠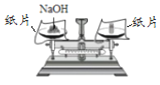
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学用语是学习化学的重要工具,化学物质在日常生活中有重要用途。
(1)写出下列化学符号:
①两个氢原子_________;②2个氨气分子_________;
③两氢氧根离子________;④氧化钙中钙元素化合价_________;
⑤地壳中含量最多的元素________。
(2)选择适当的物质填空(填字母):A.氧气 B.干冰 C.熟石灰 D.小苏打 E.明矾 F.食盐
①改良酸性土壤_____;②急救病人____;③腌制鱼肉等常用的调味品_____;
④人工降雨_______;⑤焙制糕点_____;⑥常用净水剂是_______。
(3)写出化学方程式,并回答相关问题
①铁丝在氧气中燃烧_____________。
②电解水_____________。
③盐酸除铁锈_____________。
④甲烷(CH4)完全燃烧_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置,回答问题:
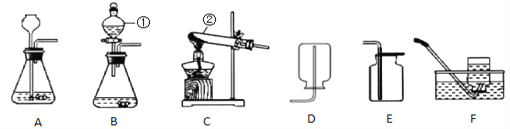
(1)写出图中标号仪器的名称:①______;②______。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气时,反应的化学方程式为______,从控制反应速率和节约药品的角度考虑,发生装置最好选用______(填序号),若用F装置收集氧气,当观察到导管口____(填序号)时开始收集气体。
a.气泡刚一冒出 b.连续均匀冒出气泡
(3)已知氨气极易溶于水,密度比空气小。实验室常用加热固体氢氧化钙与固体氯化铵混合物制取氨气,其反应的方程式为____;收集装置应选择____(填字母);验满的方法为将____石蕊试纸放在集气瓶口,观察其颜色的变化。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年辽宁省营口市】由物质分类知识可知,属于同一类物质的一组是( )
A.红磷、生铁、甲烷 B.熟石灰、石灰乳、石灰水
C.食醋、加碘食盐、酱油 D.海水、糖水、蒸馏水
-
科目: 来源: 题型:
查看答案和解析>>【题目】“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并加以利用。下图是利用氢氧化钠溶液“捕捉”CO2流程图(部分条件及物质未标出)。

请根据有关信息回答问题:
(1)大量CO2直接排放到空气中会导致____的加剧,破坏了人类生存的环境。
(2)用氢氧化钠溶液“捕捉”CO2的化学方程式是______,氢氧化钠溶液喷成雾状的目的是______。
(3)操作a的名称是______,该操作在实验室完成需要的玻璃仪器有烧杯、玻璃棒、_______,其玻璃棒的作用是______。
(4)上述流程中没有涉及到的基本反应类型是______。
(5)上述流程中,可以循环利用的主要物质有水、CaO、______(填写化学式)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质在氧气中燃烧的现象,正确的是( )
A. 硫燃烧发出淡蓝色火焰,放热,生成有刺激性气味的气体
B. 红磷在氧气中燃烧产生白雾,放出大量的热
C. 木炭燃烧生成二氧化碳,倒入瓶中的澄清石灰水变浑浊
D. 铁丝在氧气中燃烧火星四射,放热,生成黑色物质
相关试题

