【题目】测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.
(已知CaCO3+2HCl═CaCl2+H2O+CO2↑杂质不参与反应,也不溶于水)
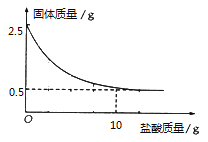
(1)石灰石样品中碳酸钙的质量是 g
(2)石灰石样品中碳酸钙的质量分数是
(3)计算稀盐酸溶质的质量分数。
【答案】(1)2克(2)80%(3)14.6%
【解析】
根据图示可知固体质量的减少量就是参加反应的碳酸钙质量,所以石灰石样品中碳酸钙的质量是=2.5克-0.5克=2克;所以石灰石样品中碳酸钙的质量分数是=2克/2.5克×100%=80%;设:恰好反应时,氯化氢的质量为x
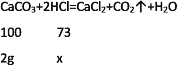
列比例式得:100:2克=73:X 解得X=1.46g.
稀盐酸溶质的质量分数为1.46克/10克×100%=14.6%

