【题目】请用所学的化学知识回答下列问题。
(1)人体中含量最高的元素_______________________。
(2)空气污染物中有害气体有 SO2、CO和____________(填化学式)。
(3)金刚石和石墨由________构成,两者物理性质差异大的原因__________石墨作电极利用其的_________性。
(4)鉴别硬水和软水常用的试剂_____________。
(5)铁丝在氧气中燃烧的主要现象____________,实验装置中集气瓶底留水或细沙的作用_______________。
(6)自来水厂中加入 ClO2进行杀菌消毒,ClO2的名称是______,该化合物中氯元素的化合价是______。
(7)下列各图中 ![]() 和
和 ![]() 分别表示不同元素的原子,其中表示化合物的是______,表示混合物的是_______(填序号)。
分别表示不同元素的原子,其中表示化合物的是______,表示混合物的是_______(填序号)。
A. B.
B.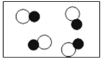 C.
C. D.
D.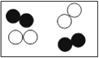
参考答案:
【答案】O NO2 碳原子 碳原子的排列方式不同 导电 肥皂水 剧烈燃烧,火星四射,生成黑色固体 防止高温熔化物溅落,使集气瓶炸裂 二氧化氯 +4 B D
【解析】
(1)人体中含量最高的元素是氧元素;
(2)空气的污染及其危害,空气污染的途径主要有两个:有害气体和粉尘;有害气体主要有一氧化碳、二氧化硫、二氧化氮等气体N2;
(3)金刚石和石墨都是由碳原子直接构成的,但两者碳原子的排列方式不同,因而物理性质有很大的差异;石墨具有优良的导电性,可作电极;
(4)硬水和软水的区别在于所含的钙镁离子的多少,生活中可用肥皂水来区分硬水和软水,产生泡沫较多的是软水,较少的是硬水;
(5)铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体;做铁丝在氧气中燃烧实验时,集气瓶底没有留水或细沙,防止铁丝燃烧的生成物溅落到集气瓶底部,使集气瓶炸裂;
(6)ClO2的名称是二氧化氯;在ClO2中氧元素显-2价,氧元素显-2价,设ClO2中氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)×2=0,则x=+4价;
(7)混合物是由两种或两种以上的物质组成,图D是两种单质组成的混合物;纯净物是由一种物质组成,图A、图B、图C都是一种物质组成,都属于纯净物;纯净物又分为单质和化合物;由同种元素组成的纯净物叫单质,图A、图C都属于单质;由两种或两种以上的元素组成的纯净物叫化合物,图B属于化合物。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有以下曲线,与之对应的叙述正确的是( )
A. 用氯酸钾制取氧气
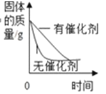
B. 加热一定质量的高锰酸钾固体

C. 在密闭容器中用红磷测定空气中氧气的含量
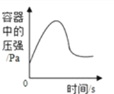
D. 发生的反应为:2KNO3
 2KNO2+O2↑
2KNO2+O2↑
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学反应的微观示意图如图
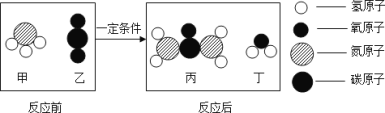
(1)甲分子中氮、氢原子个数比为_________________。
(2)图中所示物质中属于氧化物的是_____________(填字母)。
(3)已知丙的化学式CO(NH2)2,写出该反应的化学方程式________________________。
(4)氨气在纯氧中燃烧的化学方程式为:4NH3+3O2
 2N2+6H2O。根据化学方程式计算, 生成5.6g氮气需要氨气(NH3)的质量是__________?
2N2+6H2O。根据化学方程式计算, 生成5.6g氮气需要氨气(NH3)的质量是__________? -
科目: 来源: 题型:
查看答案和解析>>【题目】结合图示实验装置,回答下列问题。
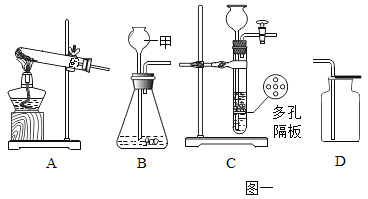
(1)实验室加热高锰酸钾制取氧气应选用的发生装置为___________(填字母),试管中棉花的作用是______________。
(2)若选B装置作为实验室制取氧气的发生装置,反应的化学方程式为:___________,某同学用D装置收集氧气,验满方法是___________。
(3)实验室可用B或C装置制二氧化碳,选用C相对于B装置的主要优点是___________。
(4)某同学用E、F装置收集一定量的氧气,装置接口连接的顺序为___________(填接口字母),量筒的作用是___________。
(5)图二中,酒精灯加网罩的目的___________。试管①中发生反应的化学方程式为:___________。
(6)图二实验停止加热时,应先将导管从试管②中撤出,并用弹簧夹夹紧橡皮管,待试管①冷却后再把试管里的粉末倒出,这样操作的原因是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某校学习小组的同学们准备测定某石灰石样品中碳酸钙的质量分数。
(提出问题)如何测定石灰石样品中碳酸钙的质量分数?
(实验设计)将样品与稀盐酸反应,测定反应后生成 CO2的体积,再根据体积换算为质量,最后根据 CO2的质量求出样品中碳酸钙的质量。下图1为大理石与稀盐酸反应的反应装置,图2用于测量 CO2的体积。
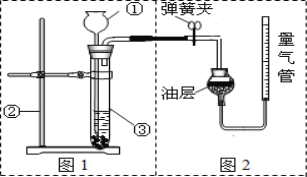
(1)写出图1中仪器的名称:②______________
(2)图1检查装置气密性的方法是:______________。
(3)图2装置中油层的作用是______________。
(4)图1中,长颈漏斗的下端必须伸入液面以下,这样做的目的是__________________,为便于控制反应速率,可用_______________代替长颈漏斗。
(5)___________(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
(实验拓展)为进一步探究固体状态与产生气体的关系,同学们进行了如下实验:将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同质量分数的稀盐酸反应进行下列测定(如图 3),经数据处理得到释放出二氧化碳的质量与反应时间的关系图(如图4)。
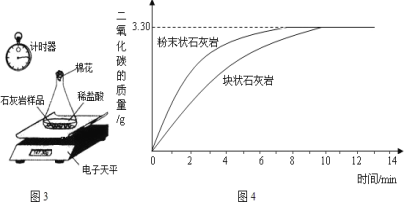
(6)图3所示实验中数据记录纸上应该连续记录的实验数据是计时器读数和____________。
(7)石灰石与稀盐酸反应的化学方程式__________________。
(8)由图 4中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,其影响实验的原因是_____。
(9)试求样品中碳酸钙的质量分数_________(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
(反思与评价)
(10)有同学认为图3 装置不能准确测定产生的气体的质量,原因是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】I.已知A、B、C、D、E五种物质中均含有某种相同的非金属元素,B为无色液体,C为黑色固体,D气体能使澄清石灰水变浑浊。图中“→”表示物质之间的转化关系。五种物质的转化关系如图所示(图中反应条件及部分反应物或生成物省略)。

(1)A、E的化学式分别是_____________、__________________。
(2)A→C反应的化学方程式是___________________________。
(3)A→B反应的化学方程式是___________________________。
II.工业制取硝酸的流程如下:
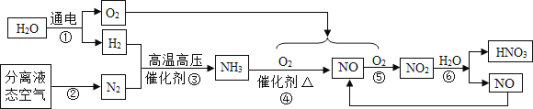
(1)步骤②是利用了氮气与氧气____________的不同,是____________变化(填“物理“或”化学“)。
(2)步骤③是化合反应,写出③的化学方程式为_______________________________。
(3)步骤④的化学方程式为 4NH3+5O2
 4NO+6X,X的化学式为_________________。
4NO+6X,X的化学式为_________________。(4)流程中一定要循环使用的物质是_____________________(写化学式)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是( )
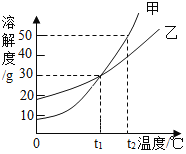
A. t1℃时,甲的溶解度大于乙的溶解度
B. t2℃时,甲和乙溶液中溶质质量分数相等
C. t2℃时,在100g水中放入60g甲,其溶质的质量分数为37.5%
D. 甲溶液中含有少量乙时,用降温结晶的方法提纯甲
相关试题

