【题目】早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱。现有含1.6kg硫酸铜的工业废液,加人铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数。
(2)理论上与硫酸铜反应消耗铁粉的质量。
参考答案:
【答案】(1)硫酸铜中铜元素的质量分数为![]() ×100%=40%;
×100%=40%;
(2)设理论上与硫酸铜反应消耗的铁粉质量为x。
Fe+CuSO4===Cu+FeSO4
56 160
x 1.6kg
![]() =
=![]() x=0.56kg
x=0.56kg
答:硫酸铜中铜元素的质量分数为40%;理论上与硫酸铜反应消耗铁粉的质量为0.56kg。
【解析】根据硫酸铜的质量,利用反应的化学方程式,列出比例式,就可计算出消耗铁粉的质量即可。(1)硫酸铜中铜元素的质量分数为![]() ×100%=40%;
×100%=40%;
(2)设理论上与硫酸铜反应消耗的铁粉质量为x。
Fe+CuSO4===Cu+FeSO4
56 160
x 1.6kg
![]() x=0.56kg
x=0.56kg
答:硫酸铜中铜元素的质量分数为40%;理论上与硫酸铜反应消耗铁粉的质量为0.56kg。
-
科目: 来源: 题型:
查看答案和解析>>【题目】地壳中含量最多的金属元素是
A. Cu B. Al C. Mg D. Fe
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列做法不符合“低碳生活”理念的是( )
A.减少使用一次性纸制品
B.保持饮水机24小时加热或保温
C.选择可反复使用的购物袋
D.养成随手关灯的习惯
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图,是一架大型客机。根据相关知识回答下列问题:
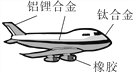
(1)图中标示的材料中,含有的金属元素是________(写出一种即可)。
(2)飞机大量使用合金材料,原因是__________________________________________。
(3)铝的金属活动性比铁的________(选填“强”或“弱”)。空气中,铝比铁具有更好的抗腐蚀性,原因是__________________________________________________________(用化学方程式解释)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铁矿石是怎样炼成铁的呢?某活动小组在实验室模拟了铁矿石炼铁化学原理,如图所示。
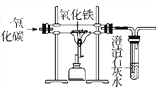
(1)该活动小组将实验装置组装好后,设计了下列实验操作步骤:①给玻璃管加热;②停止加热;③通入一氧化碳气体;④停止通入一氧化碳气体。
正确的操作步骤是____________(填序号);
(2)实验过程中,玻璃管中固体由________色变成________色,玻璃管中反应的化学方程式是____________________________________,试管中出现的现象是______________;
(3)图中有一处明显错误,请说明改进方法______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是小明设计的化学动力小车,他在试管中加入两种试剂,塞紧塞子,将小车放在摩擦系数极小的道路上,过一会小车就向前运动了。

【可选试剂】①锌粉;②铁粉;③铜粉;④10%的稀盐酸。
(1)在加入的两种试剂总质量相同的条件下,若加一次药品能使小车在同一条水平道路上行程最远,应选择的金属是__________(填序号),并且两种试剂使用的量要控制在____________________,此反应的化学方程式为________________________________;
(2)在加入的两种试剂总质量相同的条件下,要使小车运动的速度最快,应往试管中加入上述哪种金属?________(填序号),原因是________比________活泼,产生氢气速度更快;
(3)有的同学根据上述小车推进原理,发现不进行化学反应,也能使小车运动,则他在试管中投入的试剂可能是________,其利用了它的________性质。
【继续探究】【注意:若答对此部分奖励4分,化学试卷总分不超过60分。】
若仍用上述提供的试剂,在不增减小车的设备、不改变试剂总质量及道路的摩擦系数不变的条件下,从理论上讲,如何使小车跑得更远?请将改进的方法和理由填写在表中。
改进的方法
简述理由
1
________________
________________
2
________________
________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A.所有的原子都是由质子,中子,电子构成
B.原子和原子核都带正电
C.相对原子质量的单位是克
D.在原子里,质子数等于核电荷数
相关试题

