【题目】某化学兴趣小组同学,用盐酸和氢氧化钠进行“酸碱中和反应”的探究,进行一段时间后发现没有明显变化,询问老师才知道忘记滴加指示剂。因此,他们停止实验,并在老师的指导下对烧杯内的溶液中的溶质的成分进行探究。
(提出问题)该烧杯内的溶质是什么?
(猜想假设)猜想一:NaCl 猜想二:NaCl和HCl
猜想三:NaCl和NaOH 猜想四:NaCl、NaOH和HCl
同学们讨论后一致认为猜想四不合理,请你说出不合理的理由______________________(用化学方程式表示)。
(查阅资料)NaCl溶液呈中性。
(实验探究)兴趣小组甲、乙、丙三位同学分别设计了如下的实验方案,请你帮助他们完成实验报告的相关内容。
实验方案 | 实验现象 | 实验结论 |
甲同学取少量烧杯内的溶液于试管中,滴入酚酞试液 | 溶液无变化 | 猜想一成立 |
乙同学另取少量烧杯内的溶液于试管中,加入_______。 | 有气泡生成 | 猜想二成立 |
丙同学另取少量烧杯内的溶液于试管中,滴加适量的CuSO4溶液 | 没有蓝色沉淀产生 | 猜想____不成立 |
(评价反思)老师看了甲、乙、丙三位同学的实验报告,指出甲同学的实验结论不准确,请你分析甲同学实验结论不准确的原因:___________。
(得出结论)猜想二成立
(拓展延伸)某同学在进行酸碱中和滴定实验时,测得溶液的pH变化如下图1所示,请回答下列问题:

(1)由图1可知,该同学实验操作是________________。
A.将盐酸滴入氢氧化钠溶液中
B.将氢氧化钠溶液滴入盐酸中
(2)由图1可知,在b点处溶液中溶质是______________________。
(3)图2为盐酸和氢氧化钠溶液反应的微观过程,从微粒的角度分析,此反应的微观实质_______________(合理答案即可)。
参考答案:
【答案】NaOH+HCl=NaCl+H2O 锌粒(Zn)、CaCO3、Na2CO3(碳酸盐)(合理答案均给分) 三 酚酞在酸性和中性溶液中均不变色 A 氯化钠(NaCl) 氢离子和氢氧根离子结合生成水分子、H++OH-=H2O(合理答案均给分)
【解析】
(1)氢氧化钠与稀盐酸可以反应,故不能共存,反应方程式为NaOH+HCl=NaCl+H2O;
(2)溶液中一定有氯化钠,如果猜想2成立,说明溶液中有稀盐酸,故加入的物质应该是可以和酸反应能放出气体的物质,故可以是碳酸钠、碳酸钙或活泼的金属锌等;
(3)丙同学另取少量烧杯内的溶液于试管中,滴加适量的CuSO4溶液没有蓝色沉淀产生,说明溶液中没有氢氧化钠,故猜想三不成立;
(4)甲同学的实验中氯化钠和稀盐酸都不能使酚酞变色,故不能确定是否含有稀盐酸,故错误;
(5)由图1可知,反应前溶液的pH大于7 ,反应后溶液的pH小于7 ,故说明是将稀盐酸加入氢氧化钠溶液中,故选A;
(6)b点处溶液的pH=7,说明稀盐酸与氢氧化钠恰好完全反应,故反应后溶液中的溶质是NaCl;
(7)由图可知,稀盐酸与氢氧化钠的反应实质是酸中的氢离子与碱中的氢氧根离子反应生成水的过程;
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置图,回答下列问题。

(1)写出标号a仪器的名称___________,标号b仪器的名称_____________。
(2)实验室用石灰石和稀盐酸制取二氧化碳的收集装置_________,检验该气体的化学方程式为__________________________________。
(3)实验室用过氧化氢溶液和二氧化锰混合制取氧气的化学方程式________________。
(4)与集气瓶配套使用的玻璃片一般一面为光滑面,另一面为磨砂面,收集的气体用玻璃片的__________(选填“光滑面”或“磨砂面”)盖住集气瓶。
-
科目: 来源: 题型:
查看答案和解析>>【题目】核电荷数为1﹣18的元素的原子结构示意图等信息如图,请回答下列问题。

(1)2018年在新疆发现我国最大的铍(Be)矿。此元素原子的核电荷数为_____;核外电子层数为_____;氢氧化铍的化学式为_____。
(2)同周期元素,从左到右,各元素原子随原子序数的增加,核外电子数依次是_____。
(3)从Na、Mg原子结构示意图推知,金属Na、Mg化学性质不同的原因是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小甜利用石灰石和稀盐酸进行如下实验,操作过程和数据如图所示(样品中的杂质不与酸反应也不溶于水).

(1)20g石灰石样品中CaCO3的质量为_____g.
(2)列式计算不饱和溶液A的溶质质量分数为__________(结果准确到0.1%).
-
科目: 来源: 题型:
查看答案和解析>>【题目】镆是近期刚确定中文名称的元素,下列有关说法错误的是 ( )
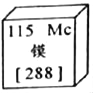
A. 镆元素为金属元素
B. 镆原子中的中子数为115
C. 镆原子中的核电荷数为115
D. 镆原子的相对原子质量为288
-
科目: 来源: 题型:
查看答案和解析>>【题目】用下列方法配制的溶液,其溶质质量分数为5%的是 ( )
A. 称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B. 称取5.0g生石灰,放入95mL水中,充分搅拌
C. 量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D. 称取5.0g碳酸钙,放入95mL水中,充分搅拌
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线。分析曲线得到的以下说法中,正确的是 ( )
①氯化钠和氯化铵是易溶物质,碳酸氢钠是微溶物质
②在20℃时,三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3
③在30℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下
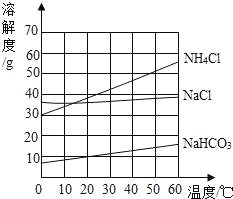
A. ①② B. ②④ C. ②③ D. ①③
相关试题

