【题目】质量均为 x 的锌粉和铁粉分别与 100g 9.8%的稀硫酸充分反应,产生的 H2的质量与反应时间的关系如图所示,下列说法正确的是( )
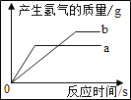
A. b 曲线表示锌的反应图象
B. 当 x<5.6 g 时,两种金属都反应完,酸过量
C. 当 5.6 g<x<6.5 g 时,和铁反应的稀硫酸过量
D. x 可能大于 6.5 g
【答案】B
【解析】
A、a曲线生成的氢气少,所以a是锌粉与稀硫酸反应的曲线,故A错误;
B、Zn+H2SO4=ZnSO4+H2↑

Fe+H2SO4=FeSO4+H2↑

所以当x<5.6g时,两种金属都反应完,酸过量,故B正确;C、当5.6g<x<6.5g时,和铁反应的稀硫酸完全反应,故C错误;D、x大于6.5g时,金属过量,酸完全反应,生成的氢气质量相等,故D错误。故选B。

