【题目】金属结构和性质等是化学研究的重要内容.
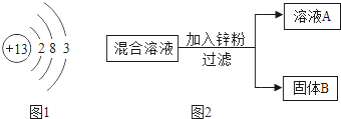
(1)如图1是铝的原子结构示意图.下列说法不正确的是________
A.铝原子的质子数为13
B.化合物中铝元素通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
(2)工业上用CO和赤铁矿石炼铁的化学方程式为________ .
(3)R是银白色金属,将稀盐酸分别加入到盛有金属Fe、R、Cu的试管中,只有Cu表面无现象;将 FeSO4溶液中分别加入到盛有金属R、Cu的试管中,只有R表面有黑色物质析出,则金属H、Fe、R、Cu活动性由强到弱的顺序是________ .
(4)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图2所示实验,下列关于溶液A中的溶质不合理的猜想及其理由是________
猜想1:只有Zn(NO3)2
猜想2:Zn (NO3)2、AgNO3
猜想3:Zn (NO3)2、Cu(NO3)2
猜想4:Zn (NO3)2、AgNO3、Cu(NO3)2
若“猜想1”成立,通过实验确定固体B的成分的方案是________
参考答案:
【答案】C;3CO+Fe2O3![]() 2Fe+3CO2;R>Fe>H>Cu;猜想2;猜想②中无硝酸铜,说明Cu(NO3)2已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银;取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物
2Fe+3CO2;R>Fe>H>Cu;猜想2;猜想②中无硝酸铜,说明Cu(NO3)2已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银;取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物
【解析】
根据原子结构示意图的意义、铝的性质、在地壳中的含量分析,炼铁的原理,金属与酸、盐的反应现象,金属活动顺序表进行分析解答。
(1)A、由铝的原子结构示意图的意义可知,铝原子的质子数为13,故A正确;B、由铝的原子结构示意图的意义可知,铝原子最外层的电子数是3,在反应中常失去3个电子,化合物中铝元素通常显+3价,故B正确;C、铝是地壳中含量最多的金属元素,氧是地壳中含量最多的元素,故C错误;D、铝可作导线是由于它具有良好的导电性,故D正确。故选C;
(2)工业上用CO和赤铁矿石炼铁时,一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(3)由题意可知,将稀盐酸分别加入到盛有金属Fe、R、Cu的试管中,只有Cu表面无现象,说明了Fe、R的活动性大于氢,Cu的活动性小于氢;由将 FeSO4溶液中分别加入到盛有金属R、Cu的试管中,只有R表面有黑色物质析出,说明了R的活动性大于铁,Cu的活动性小于铁,综上所述可知,则金属H、Fe、R、Cu活动性由强到弱的顺序是:R>Fe>H>Cu;
(4)在金属活动性顺序中,锌>铜>银,锌能与硝酸银反应生成银和硝酸锌,锌和硝酸铜反应生成铜和硝酸锌,混合溶液中加入一定量的锌粉,锌先置换出硝酸银中银,再去置换硝酸铜的铜。猜想1:当加入的锌粉时足量时,能将溶液中银、铜的全部置换出来,溶液中只有Zn(NO3)2,故猜想1合理;猜想2:猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银,也就是说只要有硝酸银时,一定也含有硝酸铜,故猜想②不合理;猜想3:当加入的锌粉时不足量时,只能将溶液中银的全部置换出来,溶液中有Zn(NO3)2、Cu(NO3)2,故猜想3合理;猜想4:当加入的锌粉时较少的,只能将溶液中银的部分置换出来,溶液中有Zn(NO3)2、AgNO3、Cu(NO3)2,故猜想4合理;
由上述分析可知若猜想1成立,锌将硝酸银、硝酸铜完全反应,固体B中一定存在Cu、Ag,可能存在Zn(当Zn过量时),Cu、Ag活动性小于氢,锌的活动性大于氢,锌与酸能发生反应生成氢气,通过实验确定固体B的成分的方案是:取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物。
-
科目: 来源: 题型:
查看答案和解析>>【题目】两种物质发生反应的微观示意图如图,下列说法正确的是( )
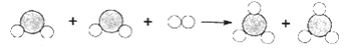
A. 反应前后物质的总质量保持不变 B. 该反应属于复分解反应
C. 反应前后分子种类保持不变 D. 该图可示意CO与O2的反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子。下列说法错误的是
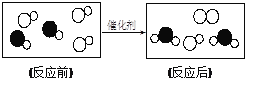
A. 此反应有单质生成
B. 原子在化学变化中是不可分的
C. 图中生成物全部是化合物
D. 参加反应的两种分子的个数比为1∶1
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为某反应在同一容器中反应前后部分分子种类的示意图。回答下列问题:

(1)氮元素和氢元素的本质区别是 , 1个A分子中共含有 个原子,C代表的是 。
(2)反应物中缺少某种物质,在反应前方框内应补充的微粒是 (填序号)。

(3)该反应中B和C的质量比为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(4分)下图中A、B、C、D是四种粒子的结构示意图。请回答下列问题:
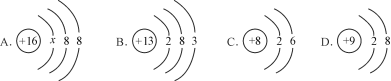
(1)A中x = ;A粒子的化学式是 。
(2)由B粒子的结构示意图可知,B粒子的名称是 。
(3)以上四种结构示意图所表示的粒子中,表示离子的是 (填字母代号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是我们所用课本中的一张,根据图示信息回答下列问题:

(1)该元素的核内质子数为________
(2)该原子的结构示意图为________
(3)若该元素元素的元素符号用A表示,则它与氧元素形成化合物的化学式为________
(4)下列对原子构成的理解错误的是_________(填字母)。
A.原子整体不显电性
B.原子核比原子小得多
C.原子核是不可分割的实心球体
D.原子质量主要集中在原子核上
(5)在元素周期表中,第二周期的八种元素中________相同。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在宏观、微观和符号之间建立联系,是化学学科的特点,如图是某化学反应的微观过程示意图(“
 ”表示氧原子,“〇”表示氢原子).
”表示氧原子,“〇”表示氢原子).
(1)从宏观角度看,物质C属于 (选填“混合物”或“纯净物”);
(2)以上变化的基本反应类型是 ;
(3)从微观角度看,物质B是由 构成的(选填“分子”或“原子”或“离子”);
(4)参加反应的A与B的微粒个数比为 .
相关试题

