【题目】海边盛产贝壳,其主要成分为CaCO3.。某化学兴趣小组称取4.0g贝壳样品,把50g稀盐酸分5次加入样品中(假设杂质不反应也不溶解),
得实验数据如下: 稀盐酸的用量 剩余固体的质量
第一次加入 10g 3.0g
第二次加入 10g 2.0g
第三次加入 10g 1.0g
第四次加入 10g 0.8g
第五次加入 10g 0.8g
请计算:(1)贝壳中碳酸钙的质量分数是____。(2)这些贝壳最多可制得多少克二氧化碳____?
参考答案:
【答案】80% 1.4g
【解析】
(1)前三次每加入10g盐酸固体减少1.0g,也就是每10g盐酸恰好和1.0g碳酸钙完全反应。而第四次只减少了0.2g,说明剩余物质不能和盐酸反应,碳酸钙已经完全反应,所以碳酸钙的质量为4.0g-0.8g=3.2g,贝壳中碳酸钙的质量分数=![]() 。
。
(2)设贝壳最多可制得二氧化碳的质量为x。
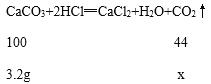
![]() x≈1.4g。
x≈1.4g。
答:(1)贝壳中碳酸钙的质量分数是80%。
(2)这些贝壳最多可制得1.4g二氧化碳。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铁是生产、生活中应用很广泛的一种金属。下列是与铁的性质有关的部分实验图,请回答下列问题。
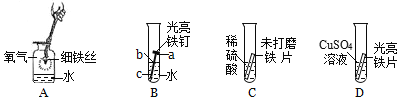
(1)A中细铁丝燃烧生成黑色固体物质的化学式是________。
(2)B中铁钉最易生锈的部位是_______(填“a”、“b”或“c”)。
(3)C中刚开始无气泡产生,过一会又产生气泡,写出产生气体反应的化学方程式是_______。
(4)D中反应一段时间后,试管内固体质量比反应前增大,据此推断,试管内溶液质量与反应前相比________(填“增大”、“不变”或“减小”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是一种重要的自然资源。
(1)水厂处理水时,有时会向水中加漂白粉,此过程发生的是______(选填“物理”或“化学”)变化。
(2)日常生活中,降低水硬度的方法是_______。
(3)电解水时,用__________来检验右图B试管中的气体。
(4)若在水中加入氢氧化钠,溶液的温度明显会____(选填“升高”或“降低”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
(提出问题)这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
(实验探究)同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中
操作
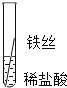
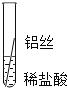
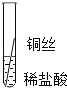
根据现象得出金属活动性顺序
片刻后的现象
有少量气泡
无气泡
无气泡
Fe>Al,Fe>Cu
几分钟后的现象
有少量气泡
有大量气泡
无气泡
__________
(讨论交流)为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
(反思评价)做金属性质实验时需将金属进行打磨,打磨的目的是 ______
(实验验证)为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
操作
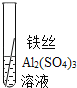
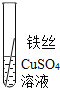
根据现象得出金属活动性顺序
现象
无明显现象
______________
Al>Fe>Cu
写出铁与硫酸铜溶液反应的化学方程式 _______。
(拓展迁移)(1)实验结束后,老师归纳总结了验证铁、铝、铜这三种金属的活动性顺序的两种方法。晓华提出还有别的方法也可以验证铁、铝、铜这三种金属的活动性顺序。她分别将铝丝和铜丝插入______溶液中(填化学式),观察现象即可知铁、铝、铜,这三种金属的活动性顺序,晓华的想法得到了大家一致赞同。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序 __________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】中国航天科技一直以来备受世界瞩目。2017年9月2日,我国成功提纯了“超级金属”铼。铼及其合金被广泛应用到航空航天领域。金属铼硬度大,熔点很高,在高温下能与硫化合形成二硫化铼。

(1)铼的相对原子质量是___________。
(2)上述信息中,属于金属铼的物理性质的是___________。
(3)七氧化二铼(Re2O7)是铼最常见的氧化物,其中铼元素的化合价为___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化氢在生产生活中有广泛应用。实验小组对过氧化氢的某些性质进行研究。
I.不稳定性
(1)如下图所示进行实验,过氧化氢分解的化学方程式为_______________,产生3.2g O2时分解的过氧化氢的质量为______ g。

(2)能用排水法收集O2的原因是______。
(3)探究温度对过氧化氢分解速率的影响
同学们进行了如下的实验,实验数据如下表:
实验序号
①
②
③
H2O2溶液的浓度%
30
30
30
H2O2溶液的体积/mL
6
6
6
温度/℃
20
35
55
MnO2的用量/g
0
0
0
收集O2的体积/mL
0
1.9
7.8
反应时间
40min
40min
40 min
由此得出的结论是_____________________________。
Ⅱ.腐蚀性
【查阅资料】H2O2溶液有腐蚀性。
【进行实验】
将铜片分别浸泡在3种溶液中进行实验,如下表。
编号
①
②
③
实验
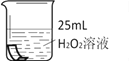
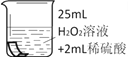
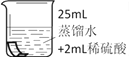
一段时间后的现象
无明显变化
溶液变蓝,缓慢产生细小气泡
无明显变化
【解释与结论】
(4)实验①的作用是_____________________。
(5)铜片被腐蚀的反应如下,补全该反应的化学方程式。
Cu + H2O2+ H2SO4=== CuSO4 +_______。
【反思交流】
(6)某同学提出,实验②中,除发生(5)的反应外,还发生了一个反应导致有细小气泡产生,该反应的反应物为_______。
-
科目: 来源: 题型:
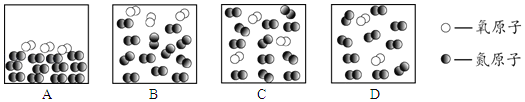
查看答案和解析>>【题目】空气属于_____(填“纯净物”或“混合物”)。空气成分中,按体积计算含量最多的气体是_____,用微观示意图表示空气的主要成分(已知在同温同压下,气体的体积之比等于分子个数之比),如图中最合理的是_____。
相关试题

