【题目】某兴趣小组展开了金属及合金的相关探究。
【探究一】口香糖包装纸表面的金属探究。
兴趣小组做了图1所示实验:取口香糖包装“锡纸”剪成条状,将“锡纸”带“锡”的一面接在电池两极,发现纸条中间处很快开始起火苗,熄灭后剩下一层薄薄的金属。“锡纸”能燃烧起来的原因是电能转化为热能,达到纸的______。同学们对“锡纸”上的金属继续展开探究。

I 探究问题一:“锡纸”上的金属是锡吗?
【查阅资料】(1)以前锡纸是用锡制造的,现在大多数是铝箔纸。
(2)“曾青得铁则化为铜”的反应原理为______(用化学方程式表示),该原理说明在一定条件下,活泼金属能置换出不活泼金属。部分金属活动性排序如下(越靠前的金属越活泼):K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au。
【实验方案】(1)将处理后的锡纸剪成小块放入小烧杯中。
(2)分别向烧杯中滴加①FeSO4溶液②CuSO4溶液③ZnSO4溶液④MgSO4溶液,观察现象。
【实验结论】根据实验现象,口香糖包装“锡纸”实际是铝箔纸。
【反思评价】上述方案中,一定不需要滴加的试剂是______(填编号)。
II 探究问题二:为什么金属没有燃烧 ?
【实验方案】(1)将一块铝箔放在酒精灯火焰上加热,轻轻晃动,发现铝熔化但不滴落也不燃烧。
(2)如图2所示把铝箔卷成筒状,下部裹一纸片。点燃纸片后立即伸入盛有氧气的集气瓶中,观察到铝箔剧烈燃烧,发出白光。

【实验分析】(1)铝箔在空气中不能燃烧的主要原因是______。
(2)铝箔在氧气中燃烧的方程式为______。夹持铝箔的仪器名称是______,集气瓶底放少量细沙的目的是______。
【延伸拓展】如图3所示,甲同学将纸卷成一空心卷,上半部包上一层铝箔,点燃下端纸卷后,发现还可以在铝箔卷上方点燃,上下形成较稳定的“子母火”现象,其原因可能是下方纸张不完全燃烧产生了______气体,该气体通过纸卷上升至铝箔卷口处燃烧,其燃烧的反应方程式是______。此过程中,下侧纸卷燃烧而接近铝箔的上侧纸卷没有燃烧,铝箔卷发挥的作用可能是______。

【探究二】某铝镁合金(用M表示)中铝含量的分析。
【查询资料】①铝镁合金国家标准:铝含量不能低于78%。
②Al和Mg均能与盐酸反应,反应方程式分别为______、____。
③铝能与NaOH溶液反应(在横线上补充一种反应物):2Al+2NaOH+2______=2NaAlO2+3H2↑。镁不与NaOH反应。
兴趣小组设计如图装置进行实验。

(1)检查该装置是否密封的操作是______。
(2)在图示Y型管两侧分别装入足量氢氧化钠溶液与a g铝镁合金粉末(固体M),使两者充分反应的操作是______;待充分反应后,进入量气管气体的体积为V mL(氢气密度用 0.09 g/L)。若量气管最大量程为100 mL,则固体M中铝的质量不应超过______g。
(3)若a =38 mg,V=30.0 mL,该合金______(填“符合”、“不符合”)国家标准;若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积______(填“>”、“<”、“=”) V mL。
参考答案:
【答案】 着火点 Fe+CuSO4==Cu+FeSO4 ②④ 铝表面生成致密氧化膜使铝和氧气隔绝 4Al + 3O2![]() 2Al2O3 坩埚钳 防止瓶底炸裂 CO 2CO +O2
2Al2O3 坩埚钳 防止瓶底炸裂 CO 2CO +O2 ![]() 2CO2 散热导致上部纸卷难以达到着火点 2Al+6HCl====2AlCl3 + 3H2↑ Mg+2HCl====MgCl2+H2↑ H2O 量气管和水准管中加适量水,上下调整水准管,看两侧是否出现稳定的液面差 向左倾斜Y型管 0.081 不符合 >
2CO2 散热导致上部纸卷难以达到着火点 2Al+6HCl====2AlCl3 + 3H2↑ Mg+2HCl====MgCl2+H2↑ H2O 量气管和水准管中加适量水,上下调整水准管,看两侧是否出现稳定的液面差 向左倾斜Y型管 0.081 不符合 >
【解析】【探究一】锡纸能燃烧起来的原因是电能转化为热能,使纸的温度达到着火点解;“曾青得铁则化为铜”的反应原理为![]() ;【反思评价】根据金属活动性顺序中,铝比铜、铁、锌活泼,不如镁活泼,硫酸锌和硫酸铁就足以证明铝的活动性,所以上述方案中,一定不需要滴加的试剂是②④;【实验分析】(1)铝箔在空气中不能燃烧的主要原因是:铝表面生成致密氧化膜使铝和氧气隔绝;(2)铝箔在氧气中燃烧的方程式为:
;【反思评价】根据金属活动性顺序中,铝比铜、铁、锌活泼,不如镁活泼,硫酸锌和硫酸铁就足以证明铝的活动性,所以上述方案中,一定不需要滴加的试剂是②④;【实验分析】(1)铝箔在空气中不能燃烧的主要原因是:铝表面生成致密氧化膜使铝和氧气隔绝;(2)铝箔在氧气中燃烧的方程式为: ![]()
![]()
![]() ;夹持铝箔的仪器名称是坩埚钳,集气瓶底放少量细沙的目的是:防止炽热的生成物溅落下来瓶底炸裂;(3)甲同学将纸卷成一空心卷,上半部包上一层铝箔,点燃纸卷后,发现可以在铝箔卷上方点燃,上下形成较稳定的“子母火”现象,原因是:下部纸卷不完全燃烧产生的CO到铝箔卷上方被点燃,其燃烧的反应方程式是:
;夹持铝箔的仪器名称是坩埚钳,集气瓶底放少量细沙的目的是:防止炽热的生成物溅落下来瓶底炸裂;(3)甲同学将纸卷成一空心卷,上半部包上一层铝箔,点燃纸卷后,发现可以在铝箔卷上方点燃,上下形成较稳定的“子母火”现象,原因是:下部纸卷不完全燃烧产生的CO到铝箔卷上方被点燃,其燃烧的反应方程式是: ![]()
![]()
![]() ,此时铝箔卷的作用是散热,防止上部纸卷燃烧;【查询资料】②Al和Mg均能与盐酸反应,反应方程式分别为:
,此时铝箔卷的作用是散热,防止上部纸卷燃烧;【查询资料】②Al和Mg均能与盐酸反应,反应方程式分别为: ![]() ;
; ![]() ;③根据反应前后原子的种类和数目不变,铝与NaOH溶液反应方程式补充为:2Al+2NaOH+2H2O =2NaAlO2+3H2↑;【探究二】(1)检查该装置是否密封的操作是量气管和水准管中加适量水,上下调整水准管,看两侧是否出现稳定的液面差;(2)在图示Y型管两侧分别装入足量氢氧化钠溶液与a g铝镁合金粉末(固体M),使两者充分反应的操作是向左倾斜Y型管;通过调整水准管的高低可以检查生成气体的体积,由题意可以知道生成氢气的体积为0.1L,则设铝的物质的量为
;③根据反应前后原子的种类和数目不变,铝与NaOH溶液反应方程式补充为:2Al+2NaOH+2H2O =2NaAlO2+3H2↑;【探究二】(1)检查该装置是否密封的操作是量气管和水准管中加适量水,上下调整水准管,看两侧是否出现稳定的液面差;(2)在图示Y型管两侧分别装入足量氢氧化钠溶液与a g铝镁合金粉末(固体M),使两者充分反应的操作是向左倾斜Y型管;通过调整水准管的高低可以检查生成气体的体积,由题意可以知道生成氢气的体积为0.1L,则设铝的物质的量为![]()
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54 6
![]() 0.1L
0.1L![]() 0.09g/L
0.09g/L
![]()
解得: ![]() =0.081g/L,所以铝的质量不应超过0.081g
=0.081g/L,所以铝的质量不应超过0.081g
根据以上解答可以知道铝的质量为:0.081g/L×0.03L=0.024g
所以铝的含量为: ![]() ≈63.9%<78%,故该合金不符合国家标准;若将装置中的氢氧化钠溶液替换为足量的盐酸,镁、铝都与盐酸反应生成氢气,改用盐酸生成氢气的体积增大,则反应停止后气管内气体体积大于VmL。
≈63.9%<78%,故该合金不符合国家标准;若将装置中的氢氧化钠溶液替换为足量的盐酸,镁、铝都与盐酸反应生成氢气,改用盐酸生成氢气的体积增大,则反应停止后气管内气体体积大于VmL。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于燃烧现象的描述中,正确的是
A.铁丝在空气中剧烈燃烧,火星四射B.红磷在空气中燃烧产生大量白色烟雾
C.镁条在空气中燃烧发出耀眼的白光D.碳在氧气中燃烧生成二氧化碳
-
科目: 来源: 题型:
查看答案和解析>>【题目】某氯化钾固体样品中含有少量氯化钙和硫酸镁等杂质,实验室提纯氯化钾流程如下:

(1)操作A的目的是使样品________。过滤时用到的玻璃仪器有漏斗、烧杯、________。实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是________________。
(2)加入过量Ba(OH)2溶液除去的杂质离子是(填离子符号)_____________,反应的化学方程式为___________________________________________。X溶液中溶质是________(填化学式)。若先加过量X溶液,再加过量Ba(OH)2溶液,则蒸发后所得固体中含有的杂质是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据实验装置图,回答下列问题:

(1)实验室用排空气法收集氧气可选用______装置(填编号)。
(2)实验室用KMnO4制氧气的反应方程式为______。用KMnO4制氧气的实验中,如果发现试管破裂,原因可能是:______(填操作失误方面的原因,指出一点即可)。
(3)实验室用B装置制取CO2的原理是______(用化学方程式表示)。可选用F装置除去CO中混有的CO2:F装置中足量澄清石灰水溶液吸收CO2反应的化学方程式为______。
(4)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。制取甲烷的发生、收集装置可选用______和______(填编号)。
(5)F装置可以收集和储备氢气,若用水将装置中的氢气排出,水应从______(填a或b)端通入。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在人们担心化石能源将被耗尽的时候,科学家发现海底蕴藏着大量可燃烧的“冰”﹣﹣“可燃冰”,其中主要含有甲烷水合物,可燃冰将成为未来新能源,但在开采技术上还存在着困难,2017年我国在可燃冰开采技术上有较大突破.

(1)写出CH4燃烧的化学方程式 .
(2)可燃冰作为未来新能源,与煤、石油相比其优点是(答一点即可).
(3)天然气作为家用燃料,有时燃气灶的火焰会出现黄色或橙色,锅底出现黑色,为避免这种现象的发生,你将如何操作? -
科目: 来源: 题型:
查看答案和解析>>【题目】(1)如图为教材中的硫燃烧实验,为什么要在瓶底放少量水?细铁丝在氧气中燃烧时,集气瓶底部也放少量水,其作用是否相同?请说明原因.
(2)硫在氧气中燃烧比在空气中剧烈,那么影响可燃物燃烧剧烈程度的因素有哪些呢?
(3)实验结束后,为减少二氧化硫的逸散,须立即熄灭硫,可采取什么方法?依据的灭火原理是什么?(写出一点即可)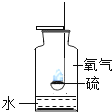
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作错误的是( )
A.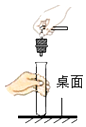
B.
C.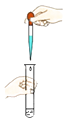
D.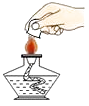
相关试题

