【题目】从H、O、N、K、Mn、Fe、Ca、S八种元素中选择适当的元素,用离子符号或化学式或化学方程式填空:
(1)2个硝酸根离子_______;(2)氢分子_______;
(3)亚铁离子________;(4)+2价的钙元素______;
(5)实验室用一种液体制取氧气:______________;
(6)剧烈燃烧,火星四射的化学反应:_____________;
(7)用一种紫色的固体加热制取氧气:_____________;
(8)生成一种有刺激性气味气体的化学反应:____________。
参考答案:
【答案】2NO3- H2 Fe2+ ![]() 2H2O2
2H2O2![]() O2↑+2H2O 3Fe+2O2
O2↑+2H2O 3Fe+2O2![]() Fe3O4 2KMnO4
Fe3O4 2KMnO4![]() K2MnO4+MnO2+O2↑ S+O2
K2MnO4+MnO2+O2↑ S+O2![]() SO2
SO2
【解析】
(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故2个硝酸根离子可表示为:2NO3-;
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则1个氢分子可表示为H2;
(3)由亚铁离子的名称可知其中的铁的化合价为+2,说明1个亚铁离子带有2个单位的正电荷,按照离子符号的书写方法可得Fe2+;
(4)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以+2价的钙元素,故可表示为:![]() ;
;
(5)双氧水在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(6)铁丝在氧气中剧烈燃烧火星四射,有黑色固体生成,反应的化学方程式为:3Fe+2O2![]() Fe3O4;(7)高锰酸钾是暗紫色固体,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4
Fe3O4;(7)高锰酸钾是暗紫色固体,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(8)硫在氧气中燃烧生成有刺激性气味的气体二氧化硫,反应的化学方程式是S+O2![]() SO2。
SO2。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质
X
Y
Z
W
反应前质量/g
10
3
90
0
反应后质量/g
3.2
3
待测
3.2
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为

-
科目: 来源: 题型:
查看答案和解析>>【题目】有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将一定量的石灰石样品放入烧杯中,再将100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
次数
第一次
第二次
第三次
第四次
加入稀盐酸的质量/g
25
25
25
25
反应后烧杯中物质的总质量/g
35.2
58.4
82.6
107.6
(1)第1次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该石灰石样品中碳酸钙的质量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下列实验图回答问题。
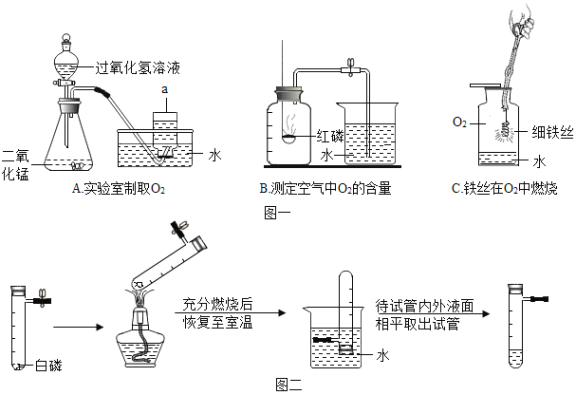
(1)仪器a的名称是________。
(2)上述三个实验中,水对实验仪器起到安全保护作用的是_____(填字母)。
(3)A实验中发生反应的化学方程式是____。
(4)对于B实验,小李同学进行了改进与创新,实验过程如下图所示:
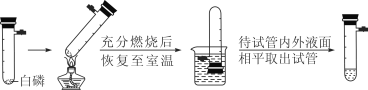
上图改进实验与B实验相比,明显的优点是_________(写一条即可)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是实验室制取气体的常用装置,回答下列问题:
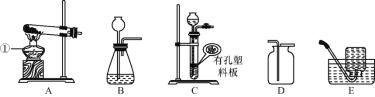
(1)图中仪器①的名称是____。
(2)若用A、E装置制取并收集氧气,其反应原理为(用化学方程式表示)________,待收集完氧气后,应先从水槽中撤出导管,再停止加热的原因是_________。
(3)实验室制取少量二氧化碳时最好选择的发生装置和收集装置分别是____(填字母序号),此发生装置的优点是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学实验室常用二氧化锰催化过氧化氢分解的方法制取氧气。那么,影响过氧化氢分解快慢的因素到底有哪些呢?某化学兴趣小组对此进行如下研究。
(提出问题)影响过氧化氢分解快慢的因素有哪些?
(猜想与假设)假设1:过氧化氢溶液的浓度;
假设2:催化剂的质量;
假设3:温度;
假设4:_______。
(设计实验)小明同学设计如下实验方案进行验证。
序号
H2O2溶液的浓度
H2O2溶液的质量
温度
MnO2的质量
收集O2的体积
时间
①
5%
12 g
20 ℃
0.2 g
125 mL
20 s
②
30%
12 g
20 ℃
0.2 g
125 mL
2 s
③
30%
12 g
40 ℃
无
125 mL
148 s
(1)通过对比实验①和②可知,过氧化氢分解的快慢与_______有关。
(2)在过氧化氢分解前后,二氧化锰的质量和_______不变。
(3)请你写出用二氧化锰催化过氧化氢分解的化学方程式:_______。
(讨论交流)(4)小红同学认为在这个实验中,必须用排水法收集氧气,理由是_______。
(5)小辉同学提出小明的方案无法验证温度对过氧化氢分解快慢的影响,请你帮他说出理由:____。
(拓展延伸)同学们查阅资料得知,FeCl3溶液对过氧化氢分解也有影响。在老师的指导下设计实验继续探究,向两支试管中分别加入等质量、不同浓度的H2O2溶液,再加入等质量、等浓度的FeCl3溶液,分别用气压传感器测定两试管中气体压力的变化曲线,如图1。
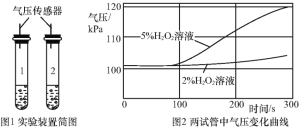
(6)为保证实验的准确性,请你设计向两试管中加入FeCl3溶液的具体方法:__。
(7)请你从图2曲线中找出FeCl3溶液对H2O2分解影响的两条规律性结论:__;____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学研究小组对蜡烛(主要由碳、氢元素组成)燃烧进行了如下探究。
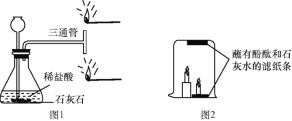
(1)设计图1所示实验,锥形瓶中发生反应的化学方程式为_____;请推测靠近三通管_____(填“上口”或“下口”)的火柴火焰熄灭,理由是__________。
(2)某同学用大烧杯将高低2支燃烧的蜡烛罩住(如图2所示),观察到高的蜡烛先熄灭,低的蜡烛后熄灭。
(提出问题)导致高的蜡烛先熄灭的原因是什么?
(猜想与假设)假设1:可能是高蜡烛火焰附近的二氧化碳浓度过高导致其先熄灭;
假设2:可能是高蜡烛火焰附近的氧气浓度过低导致其先熄灭。
(设计实验)甲同学按图2装置进行实验,点燃蜡烛,用大烧杯罩住。一段时间后,发现贴在烧杯内上部的滤纸条先褪色(石灰水能使酚酞变红,碳酸钙不能使酚酞变红),说明此时高蜡烛附近的二氧化碳浓度比低蜡烛附近的二氧化碳浓度_____(填“高”或“低”)。
(3)为进一步验证假设1,乙同学收集一瓶含20%氧气和80%二氧化碳的气体,将点燃的蜡烛慢慢伸入瓶中并密闭,蜡烛燃烧一段时间后慢慢熄灭,根据实验现象可知,假设1_____(填“合理”或“不合理”),原因是___________。
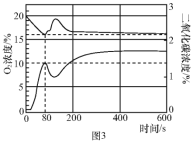
(4)丙同学使用传感器测得密闭装置内蜡烛从燃烧到熄灭的过程中(80 s时蜡烛熄灭),装置内氧气和二氧化碳含量的变化曲线如图3。则可得出蜡烛燃烧的条件是______
(5)结合已有知识和上述实验分析,乙同学的实验中,蜡烛完全熄灭后瓶内含有的气体有_____ (至少填三种)。
相关试题

