
【题目】乙炔(C2H2)是焊接金属的常用燃料。可用块状电石(主要成分为CaC2)与水混合在常温下制得,同时得到电石渣(主要成分:氢氧化钙)。请利用所学回答下列问题。
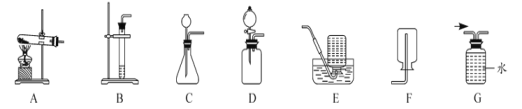
(1)用电石与水作用制取乙炔时,上图中一定不会选择的气体发生装置是_______________(填字母序号),请写出制取该气体的化学方程式:__________。
(2)乙炔密度比空气小,收集乙炔通常选择装置E而不使用F的主要原因是_____________(填序号)。
①只有装置E才能收集乙炔
②便于观察气体是否收集满
③乙炔是无色无味的气体
④便于观察产生气体的快慢
(3)由(2)中收集装置的选择推测乙炔还具有的物理性质是________。
(4)若用上图G装置收集乙炔,请将图G中的玻璃导管补画完整________。
(5)制取乙炔时,小丁发现电石与水反应十分剧烈。收集过程中集气瓶内气体还没装满,发生装置中反应已经停止不再产生气体(如图所示)。由于电石已用完,为使图中集气瓶内剩余的少量水排出,同时收集满纯净的乙炔气体,小丁接下来的操作是_________。

(6)某电石渣中含氢氧化钙92.5%,其余为杂质,若用此电石渣处理含硫酸196kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要这种电石渣的质量_________。(写出计算过程)
【答案】A ![]() ②④ 难溶于水
②④ 难溶于水 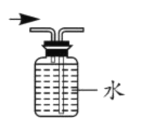 向长颈漏斗中注入水 160 kg
向长颈漏斗中注入水 160 kg
【解析】
(1)用电石与水作用制取乙炔时,应选用固、液不加热装置,A为加热固体制气体装置,上图中一定不会选择的气体发生装置是A;电石与水反应生成乙炔和氢氧化钙,化学方程式为![]() 。
。
(2)乙炔为无色气体,无法通过排空法判断是否集满,而排水法收集时,可以通过观察瓶内是否还有水,判断是否集满;另外可以根据气泡产生的速率,观察到气体生成的速率。故答案为:②④。
(3)由于气体不易溶于水才可以采用排水法收集,因此可知乙炔难溶于水。故答案为:难溶于水。
(4)乙炔密度比水小,且难溶于水,因此应从短口进气,从长口排出水达到收集气体的目的,故答案为: 。
。
(5)通过改变锥形瓶内的压强,使锥形瓶内的气体排出进入集气瓶,就可以将内部的水排出,因此往长颈漏斗内加水,压缩锥形瓶内气体体积,增大压强,气体被压出锥形瓶,进入集气瓶,将集气瓶内的水排出,从而使集气瓶内气体充满;故答案为:向长颈漏斗内注入水。
(6)设至少需要这种电石渣的质量为x
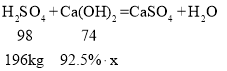
![]()
x=160kg
答:至少需要这种电石渣的质量160kg。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:初中化学 来源: 题型:
【题目】小组同学在学完中和反应知识后思考,除了通过酚酞变色说明氧氧化钠与稀盐酸能发生反应,还有什么方法能说明两者发生了反应?同学们讨论后进行以下实验探究。
方案一:测定氢氧化钠和稀盐酸混合前后的pH.
(实验探究)甲组同学将一定量的稀盐酸加入pH=13的氢氧化钠溶液中,均匀混合后测定此时溶液的pH=5.
(得出结论)稀盐酸与氢氧化钠溶液发生了反应,并且该反应中______过量.
(交流讨论)乙组同学将一定量的稀盐酸加入pH=13的氢氧化钠溶液中,均匀混合后测定此时溶液的pH=8.同学们认为该数据也能证明稀盐酸与氢氧化钠溶液发生了反应。你同意这种说法吗?______(填“同意”或“不同意”),理由是______________________________.
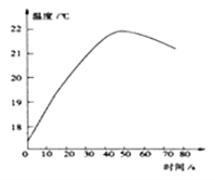
方案二:小林同学将稀盐酸逐滴匀速加入一定量的稀氢氧化钠溶液中,用数字化仪器对反应过程中溶液的温度进行实时测定,得到的曲线如图1所示。
同学们认为根据该图象也能判断出稀盐酸与稀氢氧化钠溶液发生了反应,该反应是___(填“放热”或“吸热”)反应,请你根据图中曲线判断大约___秒时二者恰好完全反应。
(反思质疑)小涛同学通过测定氢氧化钠固体与稀盐酸混合前后的温度变化,证明两者发生了反应。小组同学一致认为该方案不合理。理由是___.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
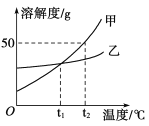
A. t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等
B. 由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C. t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90g
D. t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100 g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120 g,反应结束后溶液的总质量是215.6 g。试计算下列问题:
(知识卡片)
①洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
②HCl和NaHCO3反应的化学方程式为HCl+NaHCO3=NaCl+H2O+CO2↑
(1) 产生的二氧化碳质量为_________克。
(2) 该品牌洁厕灵中HCl的质量分数是多少?_____(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过海水晒盐可得到粗盐,粗盐除NaC1外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图。
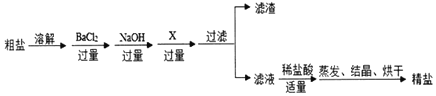
(1)加入过量BaC12溶液的目的是______(用化学方程式表示);
(2)加入试剂X的化学式是______。
(3)实验所得精盐的质量______(选填“大于”、“小于”或“等于”)粗盐中氯化钠的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在科技节上,同学们做了如图所示实验,请回答下列问题。
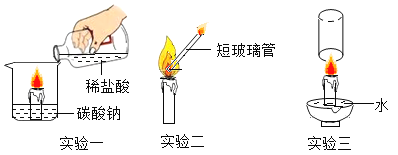
(1)实验一中,产生使蜡烛熄灭的气体的化学反应方程式是__。
(2)实验二中,若玻璃管太长,则不易观察到蜡蒸汽燃烧,其原因是__。
(3)实验三中,用玻璃杯迅速扣住燃烧的蜡烛,并使杯口始终浸没在水中。下列说法正确的有___________。
A一段时间后,蜡烛熄灭
B最终杯中液面高于盘中液面
C水面高度不再改变时,玻璃杯内水面上方气体压强不再变化
D水面高度不再改变时,玻璃杯内水面上方气体只含有二氧化碳和水蒸气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源与环境是社会关注的焦点。下图是某太阳能电池示意图,回答下列问题:
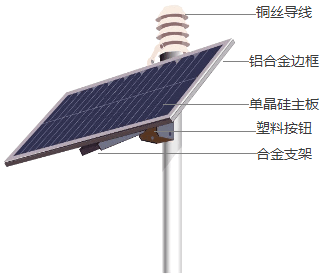
(1)图中所标物质,含有的金属元素是_____(填1种即可),含有的有机合成材料是_______。
(2)太阳能电池中多处使用合金,合金与纯金属相比,有许多优良性能,如:____(写出1条即可)。
(3)铜暴露在潮湿的空气中会生锈.即生成铜[Cu2(OH)2CO3],这是铜与O2、H2O、_____(填化学式)反应的产物。
(4)推广使用太阳能电池的意义是___________(写出1点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国制碱工业先驱侯德榜发明了“侯氏联合制碱法”。其模拟流程如下:
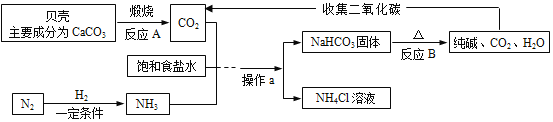
(1)“侯氏联合制碱法”的主要产品“碱”是指____________(填化学式);
(2)操作a的名称是____________;
(3)请写出反应A的化学方程式__________;
(4)在该模拟流程中,能被循环利用的物质是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程。已知碱石灰是氧化钙和氢氧化钠固体的混合物。
(工艺流程及原理)

沉淀池中发生的主要化学反应为:_____。
(讨论交流)
(1)操作a的名称是_____,若在实验室进行此操作,玻璃棒的作用是_____。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用。Y的化学式为_____。
(3)沉淀池中氨气、二氧化碳和水也可能反应生成少量NH4HCO3,该反应的化学方程式为_____。
(硫酸铵化肥等级测定)
(1)判断(NH4)2SO4化肥中有无NH4HCO3:
取少量试样溶于水,滴加足量的_____,无气泡产生,则可判断该化肥中不存在NH4HCO3。
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
(查阅资料)①已知:![]() ;氨气极易溶于水,其水溶液为氨水。氨水呈_____性(填“酸、碱或中性),不稳定,易挥发。
;氨气极易溶于水,其水溶液为氨水。氨水呈_____性(填“酸、碱或中性),不稳定,易挥发。
②工业判断硫酸铵化肥等级指标如下:
指标 项目 | 优等品 | 合格品 |
氮(N)含量 | ≥21.0% | ≥20.5% |
(实验设计)按图所示装置进行实验。
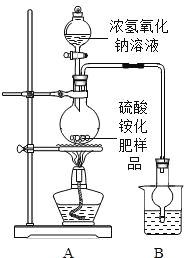
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,加热使硫酸铵充分反应完全转化为NH3.
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是_____(填序号);
①水;②浓HCl;③稀H2SO4;④NaOH溶液
(交流讨论)
实验小组的同学认为,应在实验装置A、B之间增加一个装有_____(填“浓硫酸“或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高。
(实验测定)经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验。称量样品质量13.5g,通过计算得知该化肥中含硫酸铵质量为13.2g,请你判断出化肥的等级是_____(填“优等品“或“合格品”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com