【题目】(10分)实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题: 【活动与探究一】用对比实验方法探究二氧化碳的性质。
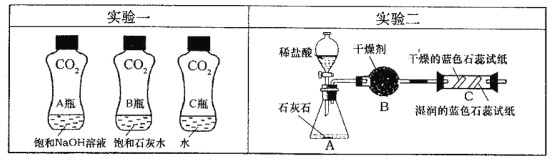
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A > B > C,其中变浑浊的瓶内发生反应的化学方程式为_ ;对比A瓶与_ (填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应。
(2)实验二观察到C装置中发生的现象是__ 结论是_
(用化学方程式表示)。
【活动与探究二】用变量控制方法探究影响物质溶解性的因素。
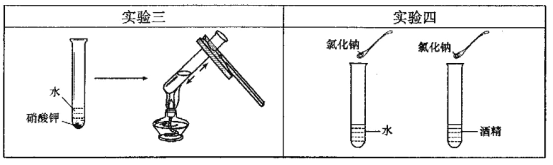
(3)实验三目的是探究 对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和.
【活动与探究三】定量测定空气中氧气的含量。
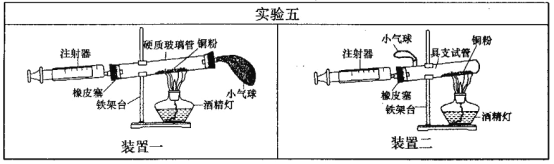
(4)实验五中,反应的原理为__ (用化学方程式表示);装置一比装置二更合理,理由是_ ;
根据下表提供的实验数据,完成下表:
硬质玻璃管 的容积 | 反应前注射器中 气体体积 | 反应后注射器中 气体体积 | 实验测得空气中氧气 的体积分数 |
30mL | 20mL | 12 mL |
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果 _ (填“偏小、‘偏大”或“无影响”)。
参考答案:
【答案】
(1)Ca(OH)2+CO2==CaCO3↓+H2O C
(2)干燥的石蕊试纸不变色;湿润的石蕊试纸变红。 CO2+H2O==H2CO3
(3)温度 溶剂的质量
(4)2Cu+O2 2CuO;
可使空气更易流通,全部通过铜粉,使氧气与铜粉充分反应。 16%;
(2)偏小。
【解析】
试题分析:(1)二氧化碳可与氢氧化钙溶液反应生成不溶于水的碳酸钙,从而观察到瓶内变浑浊;A中二氧化碳可与氢氧化钠反应,为了排除溶液中水的影响,所以应与C瓶对比。
(2)A生成的二氧化碳经B干燥后进入C中。干燥的二氧化碳不能使石蕊变色;当二氧化碳遇到湿润的试纸时,会与水反应生成碳酸,从而使石蕊变红。所以会观察到:干燥的石蕊试纸不变色;湿润的石蕊试纸变红。反应的化学方程式为:CO2+H2O==H2CO3
(3)实验三中对盛有未完全溶解的硝酸钾的试管进行加热,可探究温度对硝酸钾溶解性的影响;实验四探究的是溶剂的种类对氯化钠溶解性的影响,所以应控制温度和溶剂的质量相等。
(4)实验中利用了铜和氧气的反应,反应的化学方程式为:2Cu+O2 2CuO;
在实验过程中可通过推拉注射器使气体流通,让空气中氧气与氧化铜充分接触;以与氧化铜充分反应。气球的作用是当推拉注射器时保证装置的密封性。所以装置一中气球的位置更合理,可以使空气更易流通,全部通过铜粉,使氧气与铜粉充分反应。
根据题意可知:反应前玻璃管和注射器中均为空气,总体积为30ml+20ml=50ml。反应后气体减少的体积为20ml—12ml=8ml。所以可计算出空气中氧气的体积分数为:![]() ×100%=16%;
×100%=16%;
(2)由于反应前气球内有气体,而在反应后挤入注射器内,所以会造成测得的反应后的剩余气体增多。则计算出气体的减少值(反应的氧气的量)偏小;所以会造成结果偏小。
-
科目: 来源: 题型:
查看答案和解析>>【题目】去除粗盐中的难溶性杂质要进行过滤和蒸发操作.这两步操作用到一种共同的仪器,但作用完全不同,这种仪器是
A.玻璃棒 B.铁架台 C.蒸发皿 D.烧杯
-
科目: 来源: 题型:
查看答案和解析>>【题目】(10分)“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气 等。化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如下图所示。同学们 对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究。

【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】
①铁与氯化铁溶液在常温下反应生成氯化亚铁:Fe + 2FeCl3 =3FeCl2;
②碱性的Na2C03溶液可以与中性的CaCl2溶液发生复分解反应。
【作出猜想】久置固体中可能含有Fe、Fe203、Ca0、Ca(0H)2和CaC03。
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整。
实验操作
实验现象
实验结论
①取少量样品放入试管中,滴加一定量的 .用带异營的单孔橡皮塞塞紧试管口,导管另 一端伸入澄清石灰水中。
试管中固体逐漸减少, 有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。
样品中一定含有 ,
不含Fe203。
②取少量样品放入试管中,加水 溶解,静置后取上层清液滴加无 色酚酞试液。
试管底部有不溶物,上层清液由无色变为红色。
样品中含有 。
【实验质疑】小组同学通过讨论认为实验并不能得出一定不含Fe203的结论,理由是 、
(用化学方程式表示)。
为进一步确定这包久置的“双吸剂”固体的成分迸行如下定量实验。
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2. 6g,按照下图流程进行实验,请回答相关问题:
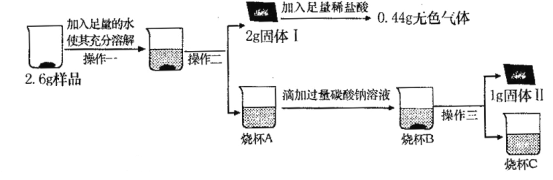
(1)操作二、操作三名称是_ 。
(2)固体I的成分是_ 。(填物质化学式,下同);
(3)烧杯A中溶液和加入的碳酸钠溶液反应的化学方程式为_ ;
(4)依据实验探究1、2中现象的分析及数据计算判断,这包久置“双吸剂”固体的成分是 。
【实验反思】
下列对实验探究1、2的反思,不正确的是_(填字母序号)。
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2烧杯C中的溶质为Na2C03和NaOH
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加人足量盐酸有4个反应发生
-
科目: 来源: 题型:
查看答案和解析>>【题目】稀盐酸和稀硫酸具有相似的化学性质,其本质原因是
A.都能与指示剂作用 B.都能解离出酸根离子
C.都能解离出氢离子 D.都含有氢元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中属于酸的是
A.H2CO3 B.NaHCO3 C.P2O5 D.Ba(OH)2
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)我市盛产石灰石,主要成分是CaC03。某同学为了测定石灰石中碳酸钙的质量分数进行了如下实验。取一定量的石灰石样品研碎和100g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25g。)
反应时间/s
20
40
60
80
100
烧杯和药品质量/g
137.8
135.6
m
134.5
134.5
请计算:
(1)表中的“m”为_ g;
(2)该石灰石样品中碳酸钙的质量分数。(计算结果精确至0.1 % )
-
科目: 来源: 题型:
查看答案和解析>>【题目】在世界范围内,据统计化肥对粮食增产的贡献率已超过40%。下图是两种氮肥标签的一部分。

请根据图示中的信息回答下列问题:
(1)从标签上看,碳酸氢铵不同于尿素的化学性质是________(填字母)。
A.易溶于水 B.受热易分解 C.有挥发性
(2)碳酸氢铵的相对分子质量为________。
(3)纯尿素中氮元素的质量分数为________,这种尿素肥料的纯度至少为________。(计算结果精确至0.1%)
相关试题

