【题目】11.2g某种铁合金样品(只含两种成分)与足量的稀硫酸充分反应后,生成0.44g氢气,则该铁合金中所含的另一种成分可能是( )
A.Cu B.Al C.Zn D.C
参考答案:
【答案】B
【解析】
试题分析:设11.2g纯铁与稀硫酸反应生成氢气的质量为x.
Fe+H2SO4═FeSO4+H2↑
56 2
11.2g x
![]() x=0.4g<0.44g
x=0.4g<0.44g
说明等质量的铁和所含杂质相比,杂质与稀硫酸反应产生的氢气多.
A、铜在金属活动顺序表中排在氢的后面,不能与稀硫酸反应,故选项错误.
B、由于铁、锌、铝的化合价与相对原子质量之比由大到小的顺序是:铝>铁>锌,则等质量的铁、锌、铝与足量的稀硫酸反应时产生的氢气质量由多到少的顺序是:铝>铁>锌,等质量的铝比等质量的铁产生的氢气多,故选项正确.
C、由于铁、锌、铝的化合价与相对原子质量之比由大到小的顺序是:铝>铁>锌,则等质量的铁、锌、铝与足量的稀硫酸反应时产生的氢气质量由多到少的顺序是:铝>铁>锌,等质量的锌比等质量的铁产生的氢气少,故选项错误.
D、碳不与不能与稀硫酸反应,故选项错误.
故选B.
-
科目: 来源: 题型:
查看答案和解析>>【题目】硼酸常用于治疗小儿湿疹.如图是硼元素在元素周期表中的相关信息.下列关于硼元素的说法中不正确的是( )
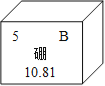
A. 元素符号为B B. 相对原子质量为10.81g
C. 原子核外有5个电子 D. 是非金属元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】请将下列错误操作可能产生的后果填在相应的横线上:
(1)倾倒液体时,试剂瓶标签没有向着手心 ;
(2)用未经清洗的胶头滴管吸取其它试剂 ;
(3)加热后的试管立即用冷水冲洗 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请从①氮气、②氧气、③二氧化碳、④氖气四种气体中选择合适的,按要求填空:
(1)空气含量最多的气体是 (2)用于制霓虹灯的气体是 。
(3)能使石灰水变浑浊的气体是 (4)绿色植物光合作用放出的气体是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作正确的是( )
A. 滴加液体
 B. 读取液体体积
B. 读取液体体积
C. 二氧化碳验满
 D. 稀释浓硫酸
D. 稀释浓硫酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验是学习化学的一条重要途径,正确的实验操作是实验成功的关键,造成下列实验后果的原因可能是:
(1)加热固体时试管炸裂: ;
(2)用高锰酸钾制取氧气,水槽中的水变成了紫红色: ;
(3)在测定空气中氧气含量的实验中,结果偏低: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种固体物质的溶解度曲线.据图回答下列问题.
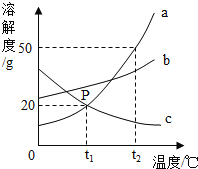
(1)P点表示的含义是 .
(2)将相同质量t2℃时的a、b、c饱和溶液的温度降低到t1℃时,析出晶体最多的是 .
(3)将t1℃时的a、b、c饱和溶液的温度升高到t2℃时,溶液质量分数最大的是 .
相关试题

