【题目】钙及其化合物在生产、生活中具有广泛的应用。
(一)钙的广泛用途
(1)高钙奶中含钙,这里的钙是指_____。(选填序号,下同)
a.单质 b.元素 c.原子
(2人体中钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其中磷元素化合价为___________。
(3)混凝土中也含有一定量的含钙物质,钢筋与混凝土混合形成钢筋混凝土,以上叙述中不涉及的材料是____。
a.无机材料 b.合成材料 c.复合材料
(二)轻质CaCO3的制备
某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,流程如下:

(1)反应Ⅱ中先通NH3,再通CO2的目的是_______,化学方程式为______。
(2)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是______。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(3)判断CaCO3固体已洗涤干净的方法是____________________;
K2SO4晶体洗涤时,不可选用下列________洗涤剂(填字母编号)。
A.热水 B.冰水 C.饱和K2SO4溶液
(三)CaSO4xH2O成分测定
上述流程中分离所得的CaSO4xH2O中含有一定量的CaCO3。实验小组为了测定CaSO4xH2O中x的值及含量,取22.20g样品加热至900℃,将得到的气体先通过浓硫酸,再通入碱石灰,测得实验数据如下表:
名称 | 浓硫酸 | 碱石灰 |
实验前 | 100.00 | 100.00 |
实验后 | 103.60 | 102.20 |
【资料】已知CaSO4xH2O在160℃生成CaSO4, CaCO3在900℃时分解完全。
(1)CaSO4xH2O的质量为_____。
(2)x的值___________。
(四)CaSO4xH2O的性质探究
CaSO4xH2O受热会逐步失去结晶水,1350℃时 CaSO4开始分解;取纯净CaSO4xH2O固体3.44g,加热,测定固体质量随温度的变化情况如下图所示。

(1)0~T1固体质量没有发生变化的原因可能是_____________。
(2)G点固体的化学式是_________。
(3)将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,反应后的固体为氧化物,则则H~I段发生反应的化学方程式为__________;m=______。
参考答案:
【答案】 b +5 b 提高二氧化碳的吸收效率 CaSO4 +CO2+ 2NH3+ H2O=CaCO3+ (NH4)2SO4 常温下,硫酸钾的溶解度较小而析出 取最后一次洗涤所得的滤液,加入BaCl2溶液,无现象 A 17.2g 2 未达到反应所需的温度 CaSO4H2O 2CaSO4 ![]() 2CaO+2SO2↑+O2↑ 1.42
2CaO+2SO2↑+O2↑ 1.42
【解析】(一)(1)单独说名称一般指元素,故选b。(2)化合物中各元素化合价的代数和为零。(3)钢筋属于无机材料,钢筋混凝土属于复合材料,故选b。(二)(1)反应Ⅱ中先通NH3,再通CO2的目的是提高二氧化碳的吸收效率, 化学方程式为 CaSO4 +CO2+ 2NH3+ H2O=CaCO3+ (NH4)2SO4 (2)常温下,硫酸钾的溶解度较小而析出。(3)因为 BaCl2 + CaSO4= CaCl2+ BaSO4↓,无现象,说明CaCO3固体已洗涤干净。温度越高,K2SO4溶解度越大,晶体质量会减少,故选A。(三)(1)设样品中CaCO3的质量为x,碱石灰增加的质量是吸收二氧化碳的质量:102.20g-100.00g=2.2g
CaCO3高温CaO+CO2↑
100 44
x 2.2g
![]() =
=![]() 解得x=5g 故CaSO4xH2O的质量为:22.20g-5g =17.2g
解得x=5g 故CaSO4xH2O的质量为:22.20g-5g =17.2g
(2)浓硫酸增加的质量是吸收的水的质量:103.60g-100.00g=3.6g
CaSO4xH2O△ CaSO4+xH2O
136+18x 18x
17.2g 3.6g
![]() =
=![]() 解得x=2
解得x=2
(四)(1)0~T1固体质量没有发生变化的原因可能是未达到反应所需的温度。(2)上面已经计算出x=2,故CaSO4xH2O是CaSO42H2O,它受热会逐步失去结晶水, 3.44g-3.08g=0.36g, 3.44g-2.72g=0.72g,据图像分析,H点的固体不含结晶水,故G点固体的化学式是CaSO4H2O。(3)二氧化硫气体能使酸性KMnO4溶液褪色,因为反应后的固体为氧化物,根据质量守恒定律,反应的化学方程式为:2CaSO4 ![]() 2CaO+2SO2↑+O2↑,根据题意,M点的固体是CaO,设生成CaO的质量是y,2CaSO4
2CaO+2SO2↑+O2↑,根据题意,M点的固体是CaO,设生成CaO的质量是y,2CaSO4 ![]() 2CaO+2SO2↑+O2↑
2CaO+2SO2↑+O2↑
272 112
3.44g y
![]() =
= ![]() 解得y=1.42g
解得y=1.42g
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列对有关事实的解释中,错误的是
A. 生铁和钢的性能不同——含碳量不同
B. 氮和氧的元素种类不同——核内质子数不同
C. 一氧化碳和二氧化碳的化学性质不同——氧原子个数不同
D. 带火星的木条在空气和氧气中的现象不同——氧气浓度不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】将16.8gNaHCO3固体加热一段时间后剩余固体13.7g,下列说法错误的是( )
A. 剩余固体为混合物
B. 剩余固体中钠元素的为4.6g
C. 反应生成CO2的质量为3.1g
D. 加热前后的固体分别与相同浓度稀盐酸恰好完全反应所消耗盐酸质量相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】碱式硫酸铁(Fex(OH)y(SO4)z)可做净水剂、颜料和药物,某兴趣小组利用硫酸厂的烧渣(主要成分为:铁的氧化物、少量FeS及SiO2),在实验室制备碱式硫酸铁,主要流程如下:
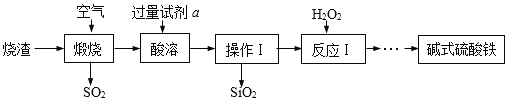
(1)操作Ⅰ中所用的玻璃仪器有烧杯、漏斗、____。
(2)煅烧时产生的SO2可选用石灰乳而不用澄清石灰水吸收的原因是_______。
(3)酸溶时加入的试剂a是_____(填序号)。
a.H2SO4 b.HCl c.HNO3
(4)反应Ⅰ中加双氧水的目的是为了将酸性FeSO4溶液氧化为Fe2(SO4)3,反应的化学方程式为_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】比较推理是化学学习中常用的思维方式,下列推理正确的是( )
A. 烧碱属于碱,故纯碱也是碱
B. 生铁比铁硬,故黄铜比铜硬
C. Al(OH)3可以治疗胃酸过多,故NaOH也可治疗胃酸过多
D. 洗涤剂对油污有乳化作用,故汽油对油污也有乳化作用
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图表示某些物质间转化关系。通常情况下,A是一种无色液体,D和E是组成元素相同的两种气体,且D有毒,F是一种红色金属,X用于改良性土壤(部分反应条件或某些反应产物未注明)。回答问题:
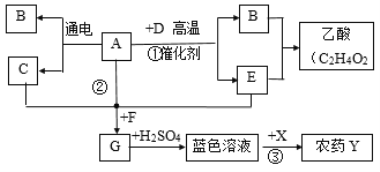
(1)写物质化学式:G_________、X______________。
(2)写出化学方程式:
①____________________。
②____________________。
(3)反应③用于配制农药Y,Y的俗称为_____________。
(4)工业上可用B和E合成乙酸,反应中B和E的质量比为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硬水中含有一定量的Ca(HCO3)2和Mg(HCO3)2,某兴趣小组的同学将一定量的硬水煮沸后出现白色固体,该小组的同学探究其成分。
查阅资料:已知可溶性的Ca(HCO3)2加热会分解,出现白色沉淀和能使澄清石灰水变浑浊的气体,分解的化学方程式为_________
【提出问题】硬水煮沸后的白色固体中还含有什么物质?
【猜想】 甲:MgCO3; 乙:Mg(OH)2; 丙:MgO
【实验】
(1)甲同学取白色固体,加入适量的稀盐酸,观察到有气泡产生,认为自己的猜想正确,其他同学否定了他的结论,理由是_______
(2)乙同学称取10.8g白色固体,设计如下实验确定固体组成:

①反应前,先通一段时间的空气,目的是_____________。
②加热一段时间后,装置C中可观察到_______(填实验现象),证明乙同学的猜想成立。
③实验中E装置的作用是___________________。
④充分反应后,测得C增重1.8g,D中增重4.4g。
【结论】(1)白色固体中各成分的质量比为______。
(2)写出Mg(HCO3)2受热分解的化学方程式_____________。
相关试题

