【题目】实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。已知:BaCl2+Na2CO3=BaCO3↓+2NaCl 请计算:

(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
参考答案:
【答案】(1)21.2g (2)13.9%
【解析】
试题分析:(1) 配制26.5%的Na2CO3溶液80g,需要Na2CO3固体为:80g×26.5%=21.2g
(2)解:从图甲中获知,当BaCl2完全转化为沉淀时消耗Na2CO3溶液的质量为40g。
设BaCl2的质量为x,则
BaCl2+Na2CO3=BaCO3↓+2NaCl
208 106
x 40g×26.5%
![]()
解得:x=20.8g (3分)
该BaCl2溶液的溶质质量分数=(20.8g/150g)x 100%=13.9%
答:该BaCl2溶液的溶质质量分数为13.9%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】右图是A、B、C三种物质的溶解度曲线。
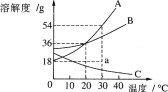
(1)20℃时,A、B、C三种物质溶解度由大到小的顺序是 。
(2)35℃时,A、B、C的饱和溶液各w g,均冷却至20℃时,析出晶体最多的是 ,较少的是 ,没有晶体析出的是 。
(3)30℃时,a点表示100g水中溶解A物质的质量,要使其变为30℃的饱和溶液,需要加入A物质的质量是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】KOH溶液中含有H2O、K+、OH、能使无色酚酞试液变成红色。某化学兴趣小组想探究KOH溶液使无色酚酞试液变成红色的原因。
【提出问题】KOH溶液中的什么成分使无色酚酞试液变红?
【猜想】猜想1:KOH溶液中的H2O使无色酚酞试液变红。
猜想2:KOH溶液中的K+使无色酚酞试液变红。
猜想3:KOH溶液中的_______________(填化学式)使无色酚酞试液变红。
【实验探究】
实验操作
实验现象
结论
①用试管取少量蒸馏水,滴入12滴无色酚酞试液
A试管内溶液不变色
猜想1不成立
②用试管取少量KCl溶液,滴入12滴无色酚酞试液
B
猜想2不成立
③________________,滴入12滴无色酚酞试液
C试管内溶液变红

【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学理由是__________________。
【拓展】①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是________________;
②KOH固体应__________保存。
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过一年的学习,同学们对化学有了一些初步认识,你认为下列说法中不正确的是( )
A.自然界中的元素是有限的,但组成的物质却是无限的
B.宏观上相对静止的物体,其构成微粒也是静止的
C.物质都具有两面性,既可以造福人类,也可能造成危害
D.化学变化是有规律可循的,如化学变化往往伴随着能量的变化
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是实验室加热高锰酸钾制取氧气的装置图,下列有关实验操作的分析错误的是
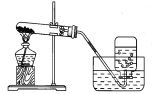
A.连接装置:先检查装置气密性,再加药品;先放酒精灯,再固定试管
B.试管口略向下倾斜:防止水倒流入试管底部,导致试管炸裂
C.收集:加热前将导管伸入装满水的集气瓶口
D.停止加热:先把导管移出水面,再熄灭酒精灯
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列符号中,既表示一个原子,又表示一种元素,还表示一种物质的是( )
A.C60 B.2H C.2H2 D.Hg
-
科目: 来源: 题型:
查看答案和解析>>【题目】能鉴别空气、氧气、二氧化碳三种气体的方法是( )
A.观察颜色 B.分别通入澄清石灰水
C.闻气味 D.插入燃着的小木条
相关试题

