【题目】洗手液是生活中常见的手部清洁剂。洗手液的主要成分有表面活性剂、抑菌剂、清香剂、防腐剂及其他助剂。洗手液的pH是国家标准中的一项重要理化指标,在最新修订的国家标准中明确指出洗手液在25℃时pH范围为4~10.
常见品牌洗手液pH
品牌 | 15℃ | 25℃ | 35℃ | 45℃ | 55℃ |
卫宝 | 9.88 | 9.72 | 9.44 | 9.36 | 9.52 |
开米 | 7.48 | 7.46 | 7.37 | 7.26 | 7.24 |
舒肤佳 | 4.58 | 4.55 | 4.26 | 4.24 | 4.38 |
蓝月亮 | 4.28 | 4.21 | 3.83 | 3.79 | 4.07 |
滴露 | 3.82 | 3.79 | 3.46 | 3.28 | 3.65 |
对于不同年龄层次、性别的消费群体:由于人的皮肤表面pH因年龄、性别的不同而有所差异,洗手液pH分布范围较广,根据皮肤的酸碱选用相应的洗手液,以免对皮肤造成刺激和伤害。例如,女性皮肤的pH明显高于男性,据此女性可选用pH稍高的洗手液.随着年龄的增长,皮肤的缓冲能力下降,皮肤生理屏作用不断降低,皮肤表面的pH逐渐近中性,因此,建议年长者选用偏中性的洗手液;而成年人皮肤表面缓冲力较强,可以根据实际需要选择酸性或碱性稍强的产品。
对于不同肤质的消费群体:不同pH的洗手液功效有一定差异,pH较低的洗手液消毒抑菌功能相对强,pH较高的洗手液则去污能力较强。建议油性皮肤的人可选购略显碱性的洗手液,而干性皮肤的人则使用偏中性、低刺激的。
建议厂家在使用说明中标出产品的pH座位参考,以便消费者能够合理选购。
依据文章内容,回答下列问题。
(1)洗手液属于 ________ (填“纯净物”或“混合物”)。
(2)从功能性上分析,其主要成分中清香剂可以去除 _____________ 。
A . 表面活性剂 B. 抑菌剂 C.清香剂 D. 防腐剂
(3)下列说法正确的是 _________ 。
A.国家标准中明确指出洗手液在25℃时,只能是弱酸性
B.在15~55℃间,随温度的升高这几种洗手液pH逐渐变小
C.科学角度看,女性和男性应该使用不同的洗手液
D. pH较低的洗手液消毒抑菌功能相对强
(4)请你从表格中为油性皮肤的人选一款洗手液 _________ (写出名称)。
参考答案:
【答案】混合物 C C D 开米或卫宝
【解析】
(1)洗手液的主要成分有表面活性剂、抑菌剂、清香剂、防腐剂及其他助剂,是由多种物质组成的,属于混合物;
(2)从功能性上分析,其主要成分中清香剂可以去除清香剂;
(3)A、国家标准中明确指出洗手液在25℃时pH范围为4~10,既有酸性又有碱性,故错误;
B、在15~55℃间,随温度的升高这几种洗手液pH逐渐变小,后又变大,故错误;
C、女性皮肤的pH明显高于男性,据此女性可选用pH稍高的洗手液,所以科学角度看,女性和男性应该使用不同的洗手液,故正确;
D、不同pH的洗手液功效有一定差异,pH较低的洗手液消毒抑菌功能相对强,故正确;
(4)油性皮肤的人可选购略显碱性的洗手液,如开米或卫宝的pH>7,显碱性。
-
科目: 来源: 题型:
查看答案和解析>>【题目】20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后,现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法不正确的是
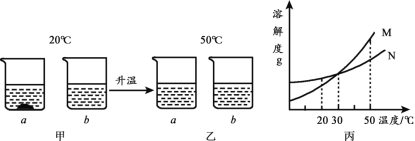
A. 图丙中M表示a的溶解度曲线 B. 图甲溶液中溶质的质量分数a大于b
C. 图乙溶液中b溶液一定不饱 和 D. 30℃时a、b溶解度相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】生产生活中蕴含着丰富的化学知识。
(1)工业上用一氧化碳和赤铁矿炼铁的原理是 ______(用化学方程式表示)。
(2)废旧钢铁表面的铁锈可用盐酸除去,其原理是_______(用化学方程式表示)。
(3)铜可用于制造传统的炭火锅,下列性质与此用途无关____的是 。(填序号)
A.熔点高 B.导热性好 C.导电性好
-
科目: 来源: 题型:
查看答案和解析>>【题目】化石燃料是人类目前使用的最主要的燃料。
(1)化石燃料包括煤、石油、__________。
(2)煤的气化是煤炭综合利用的重要途径之一,主要反应为C + H2O ====X+ H2。X的化学式______,该反应的基本类型是______.
(3)若消耗了12Kg的C,则生成氢气的质量为______ Kg。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图回答问题。
请从A或B两题中任选1个作答,若两题均作答,按A计分。
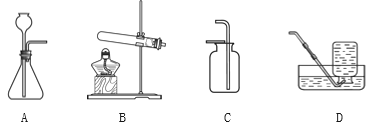
A
B
(1)实验室制取CO2化学方程式
为______。
(2)CO2可以用______(填序号)
装置收集。
(1)实验室用高锰酸钾制取 O 2 选
取的发生装置是_______。
(2)化学方程式为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
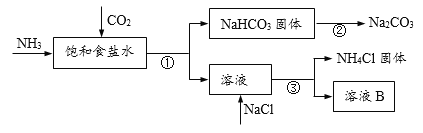
(1)① ~ ③所涉及的操作方法中,包含过滤的是______(填序号)。
(2)NaHCO3固体俗称______,其中钠元素的化合价是________。
(3)②是煅烧NaHCO3固体,分解产物有三种,分别是碳酸钠、二氧化碳、______(一种常见的氧化物)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】不少家庭养观赏鱼,有时会在鱼缸里放点鱼浮灵,可使水中的含氧量迅速增加,能有效提高鱼的成活率,并且有杀菌作用。某小组对鱼浮灵成份及原理进行了相关探究。
(实验1)检验气体
查阅资料1:鱼浮灵化学名称是过氧碳酸钠(xNa2CO3yH2O2),常温下,过氧碳酸钠易溶于水并迅速放出氧气。
实验方案1::在一支试管中加入适量的鱼浮灵,____________(将后续操作及现象补充完整),证明产生的气体是氧气。
(实验2)检验反应后溶液中的溶质成分
猜想假设:猜想1:Na2CO3 猜想2:Na2CO3和NaOH
查阅资料2:用一定溶质质量分数的NaOH和Na2CO3两种溶液进行如下实验。
NaOH溶液
Na2CO3溶液
滴加酚酞溶液
现象
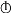
现象
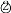
加入稀盐酸
无明显现象
现象
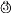
加入澄清石灰水
无明显现象
现象
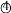
加入 1%的CaCl2溶液
溶液变浑浊
溶液变浑浊
加入 0.1%的CaCl2溶液
无明显现象
溶液变浑浊
表中的现象 _______(填序号)为溶液变红色,现象③对应的化学反应方程式为____。
实验方案 2:同学们取实验 1 反应后的溶液于试管中,加入过量_____(填“1%”或“0.1%”)的 CaCl 2 溶液,充分反应后过滤,取少量滤液,向滤液中滴加无色酚酞溶液,观察到滤液呈 _______色,证明猜想 1 正确。
(反思拓展) 根据上述探究可知,保存鱼浮灵时应注意___________。
相关试题