【题目】锌和氯化锌的固体混合物10克,放入90.2克的盐酸中,充分搅拌反应,在固体混合物全部消失后,得到100克溶液。如果盐酸也恰好全部反应,试求:
(有关反应的化学方程式为:Zn+2HCl =ZnCl2 +H2↑)
(1)根据质量守恒定律,生成的氢气质量为_______克。
(2)反应前,固体混合物中锌的质量为多少?(请写出计算过程)__________
(3)反应后,所得氯化锌溶液的质量百分数是_______。
参考答案:
【答案】0.2 6.5g 17.1%
【解析】
(1)根据质量守恒定律可知道恰好完全反应放出氢气的质量=10g+90.2g-100g=0.2g;
(2)设:参加反应的锌的质量为x,生成氯化锌的质量为y。
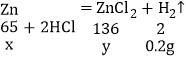
![]() x=6.5g;
x=6.5g;
![]() y=13.6g;
y=13.6g;
原混合物中氯化锌的质量=10g-6.5g=3.5g;
反应后硫酸锌溶液中溶质的质量分数=![]() 。
。
答:(1)根据质量守恒定律,生成的氢气质量为0.2克。
(2)反应前,固体混合物中锌的质量为6.5g;
(3)反应后,所得氯化锌溶液的质量百分数是17.1%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A、B、C、D是下列四种物质的一种:Fe、CuSO4、H2SO4、Ca(OH)2,且图中连线表示两种物质(或其溶液)能发生化学反应。B和C可以用来制作农用杀菌剂波尔多液。C溶液和D反应,有红色物质析出。
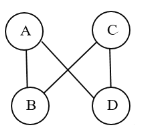
(1)B物质的俗称: __________,属于_______(填标号)。
①氧化物 ②酸 ③碱 ④盐
请举例B物质一项日常或生产中的用途:______________________ 。
(2)A和B之间的反应是_________反应(选填“吸热”或“放热”)
(3)B和C之间的反应是_________反应(填基本反应类型)
(4)C溶液和D反应的化学方程式为:________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】镁合金广泛用于航空航天、导弹、汽车、建筑等行业。镁元素的相关信息如图所示。请回答下列问题:
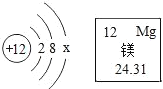
(1)镁原子的质子数为_____,x值为_____。
(2)镁属于元素_____(填“金属”或“非金属”),金属镁在化学反应在容易_____(填写“得到”或“失去”)电子。
(3)海水中含有丰富的氯化镁,目前工业上绝大多数的金属镁是从海水中提取的,其生产流程如图:
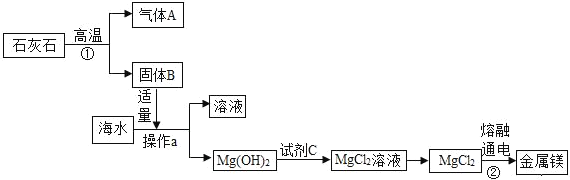
在上述流程中,通过操作a分离出固体Mg(OH)2,操作a的名称是_____,试剂C为:_____。
反应①的化学方程式为_____。
反应②的化学方程式为_____。
(4)上述流程中没有涉及到的基本反应类型是_____反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】银白色的金属钠是化学实验室中常见的药品,其化学性质十分活泼。某化学兴趣小组的同学,进行如下探究活动。
[查阅资料]
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠
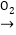 钠的氧化物
钠的氧化物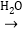 氢氧化钠溶液
氢氧化钠溶液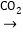 白色固体
白色固体[查阅资料]
A.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式
如:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
B.CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液发生复分解反应;
C.碳酸钠溶液与盐酸反应方程式有:
Na2CO3 +HCl=NaHCO3 +NaCl(盐酸量不足)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸量过量)
探究一:钠的氧化物是Na2O还是Na2O2 ?
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂
实验现象
实验结论
__________
__________
产物为Na2O
探究二:白色固体是NaOH还是Na2CO3 ?
(2) 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作
实验现象
实验结论
①取少量白色固体配成溶液,加入足量______
__________
猜想3成立
②过滤,取少量滤液滴入___________
__________
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是一门以实验为基础的学科。
(实验一)常见气体的制取(图1)
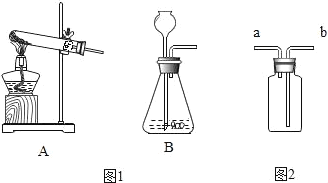
(1)实验室用高锰酸钾制取氧气,应该选用的发生装置为_____(填字母)化学方程式是:_____。
(2)实验室用双氧水(H2O2)制取氧气,应该选用的发生装置为_____(填字母),验满方法:_____。
(实验二)图2装置有多种用途
(3)排空气法收集气体:气体从a端进入,该气体必须具有的性质是_____。
(4)排水法收集气体:瓶中装满水,气体从_____(填“a”或“b”)端进入。
(5)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放_____(选填“浓硫酸”或“NaOH溶液”)。
(实验三)控制变量法是实验探究的重要方法
(6)同学们在探究铁的锈活动中,同时做了如图3的三组实验进行对比:
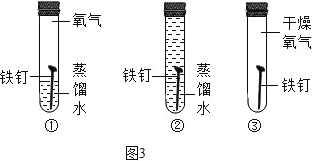
一段时间后,发现装置①有铁锈生成,装置②和装置③都没有观察到铁锈,三组实验对比可以探究铁的生锈要有_____和_____同时参加。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③双手紧贴并倒转瓶口。三步实验中测得氧气的体积分数随时间变化的曲线依次为下图中的 MN 段、NP 段和PR 段。下列说法不正确的是( )
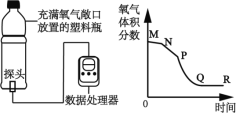
A. 曲线中 M→N 的变化过程,说明氧分子是不断运动的
B. 曲线中 M→N 和N→P 相比较,说明温度越高分子运动速度越快
C. 曲线中N→P 和P→Q 相比较,说明氧气密度比空气密度大
D. 曲线中P→Q 和Q→R 相比较,说明Q 点后氧分子的运动速度减慢
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素周期律的发现,使化学学习和研究变得有规律可循,下表列出的是1-18号元素的部分最高正化合价和最低负化合价,阅读并回答下列问题:
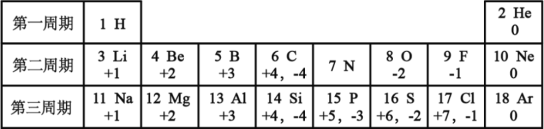
(1)12号元素属于_____(填“金属”或“非金属”)元素,它在化学反应中形成的离子与_____(填元素名称)原子具有相同的核外电子排布。
(2)氮元素的原子核外电子数为_____,其最低负化合价与氢形成的化合物的化学式为_____,该物质溶于水后形成的溶液显_____(填“酸性”、“碱性”或“中性”);某化合物中同时含有氮元素的最高正化合价和最低负化合价,写出该化合物的化学式并标出氮元素的化合价_____。
(3)第三周期元素化合价变化的趋势是_____。
(4)碳元素形成的物质种类很多,其中C和CO是初中化学常见的还原剂,当它们作还原剂时,碳元素的化合价均_____(填“上升”、“下降”或“不变”)。请判断反应NaH+H2O=NaOH+H2↑中,作还原剂的是_____(填化学式)。
相关试题

