【题目】近两年来,我国西南、北方、长江中下游等地先后遭遇大范围持续干旱.水是生命之源,我们应该了解水、爱护水资源.
(1)自然界中的水都不是纯水,利用沉淀、______、吸附和蒸馏等方法可以净化水.
(2)有些村庄打深井取用地下水,可用______区分地下水是软水还是硬水,生活中常用______的方法来降低水的硬度.
(3)小明同学为了探究水的组成,邀请你一起参加水的电解实验,发现两极上都有气泡冒出,其中正极与负极上的气体体积之比约为1:2,经检验,正极上产生的气体是______,负极上产生的气体是______.得出水是由______两种元素组成的结论,水通电分解的化学方程式______.
参考答案:
【答案】过滤 肥皂水 加热煮沸 氧气 氢气 氢、氧 2H2O ![]() 2H2↑+ O2 ↑
2H2↑+ O2 ↑
【解析】
本题考查了水的净化和水的电解,难度不大,根据已有的知识进行解答。
(1)自然界中的水可以通过沉降、过滤,吸附以及蒸馏的方法进行净化;
(2)硬水与肥皂水混合有浮渣产生,软水与肥皂水混合有泡沫产生,可以使用肥皂水鉴别硬水和软水,硬水中含有的可溶性钙镁化合物受热能产生不溶性固体,从而降低水的硬度,生活中常用加热煮沸的方法来降低水的硬度;
(3)电解水时正极生成的是氧气,负极生成的是氢气,氧气由氧元素组成,氢气由氢元素组成,化学变化中元素的种类不变,该实验说明水是由氢元素和氧元素组成的,该反应的化学方程式是 2H2O ![]() 2H2↑+ O2 ↑。
2H2↑+ O2 ↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学兴趣课上,同学们对过氧化钠(Na2O2)可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动。
(提供资料)① 二氧化碳与过氧化钠反应生成氧气和另一种物质。
② 碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)与盐酸反应均能生成CO2。
③ 2Na2O2 + 2H2O= 4NaOH + O2↑。
(1)证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。同学们在老师的指导下设计了如下图所示装置。
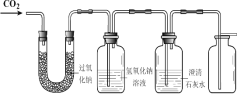
① 如何证明氧气已经收集满 ______。
② 氢氧化钠溶液的作用是除去未反应的二氧化碳,若观察到________ ,说明二氧化碳已经除尽。
(2)探究二氧化碳与过氧化钠反应生成的另一种物质。
(猜想与假设)下面是同学们提出的3种猜想。
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
通过对反应物中有关元素的组成分析,你认为猜想_____是不正确的,理由是____。
(进行实验)同学们通过以下实验验证了另一种物质,请完成下述实验报告。
实验操作
实验现象
实验结论
取少量CO2与Na2O2反应后的固体于试管中,___________。
有大量气泡产生,澄清石灰水变浑浊。
猜想_____ 是正确的。
(反思与评价)若用人呼出的气体通过上图装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意这种做法,并阐述理由____ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示实验操作规范的是
A. 将铁钉放入试管
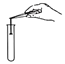 B. 氢气验纯
B. 氢气验纯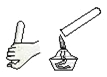
C. 移走蒸发皿
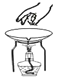 D. 合作滴加液体
D. 合作滴加液体
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是五种粒子的结构示意图,下列说法错误的是( )

A.图中粒子共能表示四种元素
B.图中表示阴离子的是c、e
C.图中b粒子的化学符号为Mg2+
D.图中d粒子在化学反应中易失去电子
-
科目: 来源: 题型:
查看答案和解析>>【题目】在用白磷(白磷与红磷组成相同,着火点为40℃)探究质量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示。请回答下列问题:
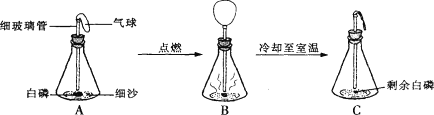
(1)此实验能否不用气球,改为直接用橡皮塞使锥形瓶密封?且说明理由____________
(2)实验中观察到气球先变大后变小,用理化知识解释产生此现象的原因是____________
(3)该同学联想到以前测定氧气体积分数时也用到红磷,且当时红磷必须过量,请解释原因。________。经过分析该同学认为上述探究质量守恒定律的实验中红磷也应过量,你认为她的观点正确吗?并加以解释____________________
(4)上述探究质量守恒定律的实验后,该同学为了验证锥形瓶内是否还有氧气剩余,用如下方法:打开瓶塞,用燃着的木条伸入锥形瓶,发现木条继续燃烧,说明瓶内还有少量氧气剩余。请你评价其实验方法正确与否,并解释:____________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验设计能够实现其对应实验目的的是
A.
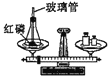 验证质量守恒定律
验证质量守恒定律B.
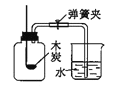 测定空气中氧气的含量
测定空气中氧气的含量C.
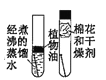 探究铁钉锈蚀的条件
探究铁钉锈蚀的条件D.
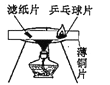 探究燃烧的条件之一:温度达到着火点
探究燃烧的条件之一:温度达到着火点 -
科目: 来源: 题型:
查看答案和解析>>【题目】某校研究性学习小组用下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
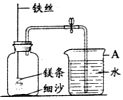
(1)图中A仪器的名称是________,燃烧、冷却后打开止水夹,水能进入集气瓶的原因是_____________。
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的_____%。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
(发现问题)氮气是怎样减少的呢?
(假设一)氮气与镁条反应而减少。
(假设二)__________。
(查阅资料)镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化镁中氮元素的化合价为_________。
镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁,该反应化学方程式是__________。
(拓展延伸)由此你对燃烧的新认识________
相关试题

