【题目】金属材料广泛应用于生产生活中。
(l)铝块能制成铝箔是利用了铝的________性(填“导电”或“延展”)。
(2)为探究铝、铜的金属活动性顺序,某同学选用了下列药品进行实验,其中可行的是______(填字母)。
A.铝丝、铜丝、氯化镁溶液 B.铝丝、铜丝、硫酸铜溶液
(3)A~G是初中化学常见的物质。己知A为黑色固体单质,B为红棕色粉末,C为无色气体,G为紫红色固体单质,它们的转化关系如下图所示,回答问题。
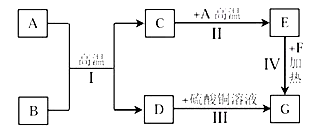
① 写出化学式:A______;B______。
② 反应II的化学方程式为_________________。
③ 反应III的化学方程式为_________________。
(4)用1600t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为_____t (结果保留至0.1)。
参考答案:
【答案】(1)延展;(2)B;
(3)①C;Fe2O3;②CO2+C![]() 2CO;③Fe+CuSO4=FeSO4+Cu;
2CO;③Fe+CuSO4=FeSO4+Cu;
(4)933.3
【解析】(1)铝块能制成铝箔是利用了铝的延展性;(2)A.铝丝、铜丝都不与氯化镁溶液反应,不能验证两种金属的活动性; B.铝丝和硫酸铜溶液反应,证明铝的活动性比铜的强;(3)A~G是初中化学常见的物质。己知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,所以A为碳,B是氧化铁,氧化铁和碳高温下反应生成铁和二氧化碳;二氧化碳和碳高温下反应生成一氧化碳,反应方程式为 CO2+C![]() 2CO;③铁和硫酸铜反应生成铜和硫酸亚铁,反应方程式为Fe+CuSO4=FeSO4+Cu;(4)用1600t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为1600t×80%×
2CO;③铁和硫酸铜反应生成铜和硫酸亚铁,反应方程式为Fe+CuSO4=FeSO4+Cu;(4)用1600t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为1600t×80%×![]() ÷96%≈933.3t
÷96%≈933.3t
-
科目: 来源: 题型:
查看答案和解析>>【题目】对下列相关问题的解释不正确的是
A.CO和CO2化学性质不同是因为分子构成不同
B.汽油和洗涤剂都能洗去油污是因为二者都具有乳化作用
C.牛奶在夏天比在冬天易变质是因为温度越高化学反应速率越快
D.木炭在氧气中比在空气中燃烧更旺是因为反应物浓度不同反应现象不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
(1)从宏观上观察:如右图所示,试管a和b中产生气体的体积比约为_____,b中产生的气体是_________(填化学式)。
(2)从微观上分析:下列说法正确的是______(填字母)。

A.水是由氢气和氧气组成的
B.水是由氢原子和氧原子构成的
C.每个水分子是由2个氢原子和l个氧原子构成的
(3)从符号上表示:电解水的化学方程式为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】能源利用和环境保护是人类共同关注的问题。
(l)下列说法中正确的是________(填字母)。
A.煤、石油和天然气都属于可再生能源
B.从环境保护角度考虑,最理想的燃料是汽油
C.可燃冰将成为未来新能源,其中主要含有甲烷水合物
(2)煤燃烧时排放出的二氧化硫等污染物,有可能会导致降雨的酸性增强。我们把pH______5.6(填“>”“=”或“<”)的降雨称为酸雨。某电厂为防止环境污染,用石灰石浆来吸收二氧化硫,其反应的化学方程式为:2CaCO3 +2SO2+O2=2CaSO4+2x,则x的化学式为________。
(3)研究发现,二氧化碳和氢气在催化剂作用下转化为甲醇(CH3OH)和水。该反应的化学方程式为________。
(4)将一定质量的甲醇与4.4g氧气混合于密闭容器内,在一定条件下,发生如下反应:
8CH3OH+xO2
 mCO2+2CO+16H2O。当反应物完全耗尽且全部转化为生成物时,有3.6g水生成,同时生成二氧化碳的质量为_______g。
mCO2+2CO+16H2O。当反应物完全耗尽且全部转化为生成物时,有3.6g水生成,同时生成二氧化碳的质量为_______g。 -
科目: 来源: 题型:
查看答案和解析>>【题目】空气中体积分数约为78%的气体是
A.氮气 B.氧气 C.二氧化碳 D.水蒸气
-
科目: 来源: 题型:
查看答案和解析>>【题目】写出下列反应的化学方程式。
(1)镁在氧气中燃烧______________;
(2)锌和稀硫酸反应______________;
(3)氢械化钠溶液与稀盐酸混合______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下列实验装置,回答问题
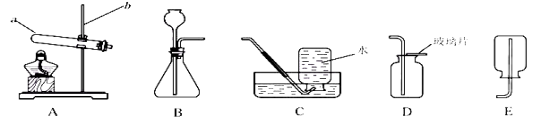
(l)写出仪器a和b的名称:a________,b________。
(2)加热氯酸钾和二氧化锰的混合物制取氧气,该反应的化学方程式为________。
(3)用石灰石和稀盐酸制取并收集二氧化碳,选用的装置为________(填字母)。
(4)与集气瓶配套使用的玻璃片一般一面为光滑面,另一面为磨砂面,收集气体时用玻璃片的________盖好集气瓶(填“光滑面”或“磨砂面”)。
相关试题

