【题目】我县盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
方案一:取20g石灰石粉末样品置于如图所示装置,充分加热至质量恒定(杂质加热不分解),冷却后称得固体质量为16.48g。
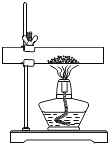
方案二:另取20g同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸(杂质不与稀盐酸反应),充分反应后称得混合物的总质量减少了8.36g。
计算出两种方案测得的石灰石中碳酸钙的质量分数:
(1)方案一中碳酸钙的质量分数是 ;
(2)方案二中碳酸钙的质量分数?
(3)比较两方案测量的结果,分析两方案误差较大的可能原因?
参考答案:
【答案】(1)40%;(2)95%;(3)可能是酒精灯火焰温度偏低,石灰石粉末未能完全分解,导致误差较大
【解析】(1)根据质量守恒定律,方案一中生成的二氧化碳的质量为:20g-16.48g=3.52g
设参加反应的碳酸钙的质量为x
CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
100 44
x 3.52g
![]()
x=8g
则样品碳酸钙的质量分数为![]() ×100%=40%
×100%=40%
由于石灰石的煅烧是需要高温,而方案一是酒精灯加热,温度偏低,可能会导致碳酸钙不能完全分解.
(2)根据只有碳酸钙和盐酸反应,所以减少的就是碳酸钙,所以碳酸钙的质量为8.36g;则样品碳酸钙的质量分数为![]() ×100%=41.8%
×100%=41.8%
(3)由于石灰石的煅烧是需要高温,而方案一是酒精灯加热,温度偏低,会导致碳酸钙不能完全分解,误差较大。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种。某同学对1、2、3、4处水质监测时记录了以下现象。
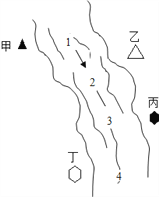
1
2
3
4
记录现象
无色溶液
蓝色浑浊
浑浊消失
产生气泡
请回答下列相关问题:
(1)根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是(________)
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:氢氧化钠
(2)若要检验甲厂排出的废水的酸碱性,可以选择的试剂是____________;
(3)2、3两处的化学方程式_______________________、_______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取气体时所需的一些装置如图所示,请回答下列问题:
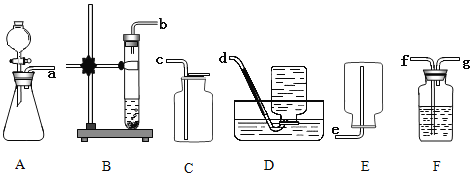
(1)实验室用过氧化氢溶液和二氧化锰混合制取氧气的化学方程式为_____________;可选择的发生装置有__________(填字母);选择气体收集方法时,气体的下列性质:①颜色;②密度;③溶解性;④可燃性;⑤是否与水或空气的成分反应,必须考虑的是________(填序号)。
(2)MnO2在该反应中可以重复使用,理由是__________________________________。
(3)要收集一瓶干燥的氧气,用到F装置,则该装置内所盛的试剂是_________(填名称),所选择装置的玻璃管的连接顺序为___________(填字母)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】李明同学进行酸碱中和反应的实验(如图所示)。他向氢氧化钠溶液中滴加一定量稀盐酸后,突然想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,他从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是他对烧杯中的溶液进行了以下探究:
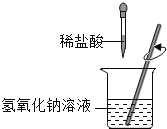
(1)李明认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸过量。
王朋同学却断定不可能“氢氧化钠有剩余”,他的理由是:__________________________;
(2)他们两个共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写下表:
实验方法
可能观察到的现象
结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。
如果_____;
则盐酸过量
如果_____;
则盐酸与氢氧化钠恰好完全反应
经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是(填序号)_______。
A.生锈的铁钉B.碳酸钠粉末C.硫酸钠粉末
(4)如图曲线能够表示李明同学所做实验中溶液pH变化趋势的是__________(填序号,下同)。
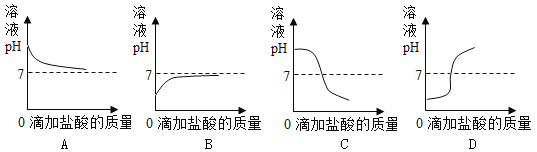
(5)李明同学所做的实验的微观粒子间的反应可以用下图表示,下列说法正确的是_____。
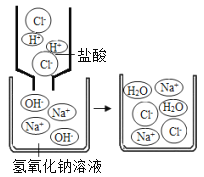
A.盐酸溶液中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
D.两种溶液混合时,钠离子与氯离子结合生成了氯化钠离子
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列做法不正确的是
A.煤气泄漏,立即关闭阀门并轻轻开窗通风
B.燃着的酒精灯不慎碰倒,洒出的酒精燃烧起来,立即用湿抹布盖灭
C.启用闲置的沼气池前,先用燃着的蜡烛进行试验
D.烧菜时油锅着火,立即用锅盖盖灭
-
科目: 来源: 题型:
查看答案和解析>>【题目】有关CuSO4制备途径及性质如图所示。
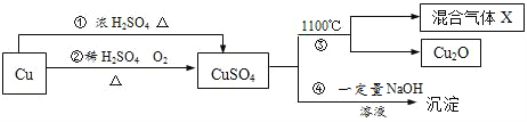
已知:
(1)Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。(2)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
下列说法正确的是
A. 途径②比途径①更好地体现绿色化学思想
B. 途径①中80g铜与200g98%浓硫酸反应可得到160g硫酸铜
C. 反应③分解所得混合气体X的成分是SO2和SO3
D. 若步骤4中所得沉淀为Cu(OH)2和CuSO4·3 Cu(OH)2,则沉淀中铜元素含量较CuSO4中铜元素含量大
-
科目: 来源: 题型:
查看答案和解析>>【题目】用NaOH固体配置200g10%的NaOH溶液,下列装置或操作正确的是
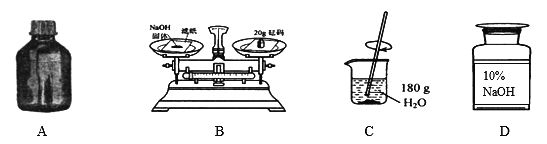
A. NaOH的固体保存 B. 用天平称取NaOH固体
C. 加水溶解氢氧化钠固体 D. 将配好的溶液装瓶存放
相关试题

