【题目】(6分)某小组同学利用如图所示装置探究铁生锈的条件(铁锈可视为Fe2O3·nH2O),其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。
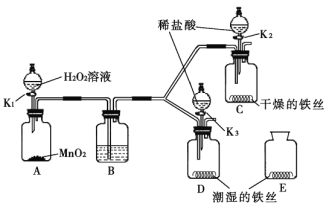
(1)步骤一:关闭K2和K3,打开K1,A中反应的化学方程式是 ,B中所盛放的试剂是 。对比铁丝表面的变化,能够说明铁生锈与水有关的是装置 (填C、D或E,下同),能够说明铁生锈的快慢与氧气浓度有关的是装置 。
(2)步骤二:关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,C中发生的化学反应方程式为 ,充分反应后D的溶液中一定含有 (填化学式)。
参考答案:
【答案】(1)2H2O2 ![]() 2H2O + O2↑ 浓硫酸 C D D E
2H2O + O2↑ 浓硫酸 C D D E
(2)Fe +2 HCl = FeCl2 +H2↑ FeCl3
【解析】
试题分析:(1)打开K1,分液漏斗中的H2O2溶液与二氧化锰接触,故A中反应的化学方程式是:2H2O2![]() 2H2O + O2↑;因为所示装置是探究铁生锈的条件,故B中所盛放的试剂是浓硫酸,除去氧气中的水分,以控制变量;对比铁丝表面的变化,能够说明铁生锈与水有关的是装置C(干燥的铁丝,无水)、D(潮湿的铁丝,有水);能够说明铁生锈的快慢与氧气浓度有关的是装置:D(氧气浓度大)、E(空气中,氧气浓度小)
2H2O + O2↑;因为所示装置是探究铁生锈的条件,故B中所盛放的试剂是浓硫酸,除去氧气中的水分,以控制变量;对比铁丝表面的变化,能够说明铁生锈与水有关的是装置C(干燥的铁丝,无水)、D(潮湿的铁丝,有水);能够说明铁生锈的快慢与氧气浓度有关的是装置:D(氧气浓度大)、E(空气中,氧气浓度小)
(2)关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,由于C中无水,铁丝不生锈,故发生的化学反应方程式为:Fe +2 HCl = FeCl2 +H2↑;而装置D中的铁丝生锈形成铁锈,主要成分是氧化铁,与盐酸反应生成FeCl3,充分反应后D的溶液中一定含有FeCl3
-
科目: 来源: 题型:
查看答案和解析>>【题目】负质子、正电子都属于反粒子,它们与质子、电子的质量、带电量均相等,但电性相反。那么根据你的理解,下列关于反氢原子的叙述正确的是
A.由一个带正电的质子和一个带负电的电子构成
B.由一个带负电的质子和一个带正电的电子构成
C.由一个带负电的质子和一个带负电的电子构成
D.由一个带正电的质子和一个带正电的电子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列由分子构成的物质中含有多种分子的是
A.水 B.糖水 C.二氧化碳 D.冰水混合物
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)用化学用语表示:
(1)2个氮原子 ; (2)+2价的铁元素 ;
(3)5个碳酸根离子 ; (4)缺少 元素会得株儒症;
(5)植物光合作用得到的单质 ; (6)不含金属元素的碱
-
科目: 来源: 题型:
查看答案和解析>>【题目】人们生活中需要的大多数能量是由化学变化提供的,下列能量主要由化学变化产生的是
A.电灯通电发光 B.水电站利用水力发电
C.用煤气煮饭 D.用太阳能热水器烧水
-
科目: 来源: 题型:
查看答案和解析>>【题目】(10分)下面是某工厂苛化法生产烧碱的示意图。请回答下列问题:
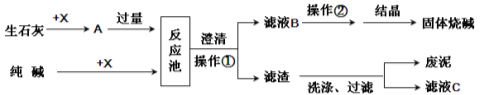
(1)烧碱属于 (填酸、碱或盐),应该 保存,否则烧碱会变质,其原因是 。
(2)X的化学式是 _,生石灰可以由 (填名称)高温煅烧而得,其反应的化学方程式为 。
(3)操作②的名称是 ;结晶得到的固体烧碱中可能含有少量的 ;烧碱有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,可先用较多的水冲洗,再涂上稀 溶液。
(4)滤液C可加入反应池循环再利用,目的是降低生产成本和防止 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化属于化学变化的是
A.汽油挥发 B.棉线织布 C.酒精燃烧 D.干冰升华
相关试题

