【题目】某研究性学习小组对中和反应进行探究,请你参与实验:
实验1:证明酸和碱发生了反应
在烧杯中加入5毫升氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈________色。再用滴管慢慢滴入稀盐酸,并用玻璃棒__________,至溶液颜色恰好变为无色为止,该反应的化学方程式是_________.
实验2:证明酸和碱反应有水生成
小明同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行如图所示的三个实验.

(1)实验①②的实验目的是______________________________.
(2)加入试剂后,要迅速塞紧橡胶塞的原因是______________________.
(3)能证明酸和碱反应有水生成的现象是__________________.
实验3:探究酸和碱反应过程的热效应
在滴加稀盐酸的过程中,利用温度传感器测量实验过程中烧杯内液体温度的变化情况,如下图为该反应中温度与滴加的硫酸质量变化关系的理论值和测量值的曲线比较情况.
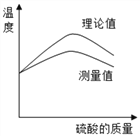
(1)图示说明酸和碱的反应是____________(填“吸热”或“放热”)反应,实验中测得的中和反应放出的热量比理论值_________(填“高”或“低”).
(2)请指出造成理论值和测量值差异的一点原因___________________________________________.
(3)图中温度达到最高值后降低的原因___________________________________________________.
参考答案:
【答案】 红 搅拌 NaOH+HCl=NaCl+H2O 证明了无水醋酸和氢氧化钠不含有水,不能使硅胶变色 防止空气中的水分进入试管干扰试验 管③中的硅胶由蓝色变为红色,试管①②中的硅胶不变色 放热 低 没有采取隔热处理 完全反应后不再放热,继续加入温度较低的稀硫酸时会降温,同时溶液散热
【解析】本题考查了验证中和反应发生,从溶液的酸碱性变化,水的生成,热量的放出三个方面分析。本题属于实验探究题,综合性较强,既有实验探究,又有实验数据图象的分析。
实验1:在烧杯中加入5毫升氢氧化钠溶液,滴入几滴无色酚酞溶液,氢氧化化钠溶液呈碱性,此时溶液呈红色。再用滴管慢慢滴入稀盐酸,为了使反应充分,要用玻璃棒搅拌,至溶液颜色恰好变为无色为止,氢氧化钠与盐酸反应生成了氯化钠和水,该反应的化学方程式是NaOH+HCl=NaCl+H2O;
实验2:(1)硅胶吸水后由蓝色变红色,实验①②的实验目的是证明了无水醋酸和氢氧化钠不含有水,不能使硅胶变色;
(2)空气中含有水,也能使硅胶变色,迅速塞紧橡胶塞,可防止空气中的水分进入试管干扰试验;
(3)能证明酸和碱反应有水生成的现象是:管③中的硅胶由蓝色变为红色,试管①②中的硅胶不变色;
实验3:(1)反应过程中溶液的温度不断升高,说明酸和碱的反应是放热反应;实验中测得的中和反应放出的热量比理论值低;
(2)造成理论值和测量值差异的原因有没有采取隔热处理,引起热量的散失;
(3)图中温度达到最高值后降低的原因是完全反应后不再放热,继续加入温度较低的稀硫酸时会降温,同时溶液散热。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸,用右图装置完成表中实验,回答下列问题。

实验序号
①
②
③
④
实验温度/℃
25
25
70
70
试剂
稀氨水
稀醋酸
稀氨水
稀醋酸
出现铁锈
所需时间
1天
未见锈蚀
5分钟
1天
未见锈蚀
1分钟
(1)铁锈的主要成分是________(填化学式)。
(2)实验②和④可探究________因素对铁制品锈蚀快慢的影响;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是______________(填实验序号)。
(3)根据表中实验现象得出的结论是_________________(写出1点即可)。
(4)影响铁制品的锈蚀快慢除上述因素外,还有______________________(写出1点即可),请设计实验方案_________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】植多家庭开始使用“扫地机器人”,它不仅可以帮助我们扫地,而且简单实用。如图是某品牌扫地机器人内部的结构示意图,请回答下列问题:

(1)机身外壳材料的主要成分是铝合金,它属于_____________(填“纯净物”或“混合物”),与单质铝相比,它的硬度更_____________(填“大”或“小”),写出铝离子的结构示意图:_____________.
(2)请用化学方程式表示金属铁、铝的活动性顺序_____________.
(3)根据扫地机器人的制造、使用情况,谈一谈化学与生活的关系______________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过一年的化学学习,相信你已掌握了实验室制取气体的有关知识.请结合图示回答下列问题.
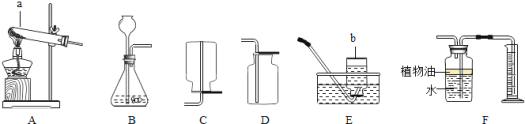
(1)请写出图中标号a、b仪器的名称:a ;b .
(2)实验室常用过氧化氢溶液和二氧化锰混合制取氧气,发生反应的化学方程式为 ,选用的发生装置是 ,(填装置序号,下同)收集装置是 .
(3)F装置可用来测量生成的CO2气体的体积,在水面上放一层植物油的目的是 ,植物油上方原有的空气对实验的结果 (填“有”或“没有”)明显影响.
-
科目: 来源: 题型:
查看答案和解析>>【题目】清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图(图中的微粒恰好完全反应).下列说法正确的是( )
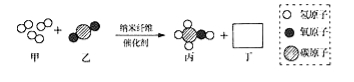
A.丁的化学式为H2O,该反应为置换反应 B.参加反应的甲与乙的质量比为3:1
C.甲是单质,乙、丙、丁均为氧化物 D.该反应体现了无机物可以转化为有机物
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示进行有关碳及其氧化物的性质实验,不正确的说法是
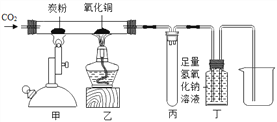
A. 甲、乙两处的现象分别是:黑色粉末减少,黑色粉末逐渐变红
B. 甲处发生的反应中,二氧化碳作氧化剂
C. 丙处试管可防止液体倒吸
D. 该装置的不足之处是未进行尾气处理
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图表示是KNO3和NaNO3的溶解度曲线。下列说法正确的是
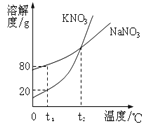
A.t1℃时,两种溶液中溶质质量分数一定不相等
B.t1℃时,在50g水里加入15g KNO3固体,充分溶解,得到60g溶液
C.t1℃时,硝酸钾、硝酸钠两物质饱和溶液升温到t2℃后,溶质质量分数相等
D.两种饱和溶液从t2℃降温到t1℃时,析出晶体:硝酸钾一定多于硝酸钠
相关试题

