【题目】为测定某硫酸铜样品中硫酸铜的含量(杂质不溶于水,不含铜元素,不与其他物质发生反应),进行了如下实验
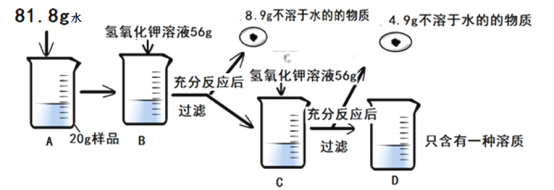
(1)上述实验过程中发生反应的化学方程式为___________。
(2)根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式______。
(3)配制上述实验所用的氢氧化钾溶液,需要质量分数为20%的氢氧化钾溶液的质量为______。
(4)样品中硫酸铜的质量分数为_____。
(5)D烧杯溶液中溶质的质量分数为______。
(6)若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为_________。
参考答案:
【答案】 2KOH+CuSO4===Cu(OH)2↓+K2SO4 ![]() =
=![]() 56g 80% 8.7% 300kg
56g 80% 8.7% 300kg
【解析】(1)烧杯B中发生的反应是:2KOH+CuSO4===Cu(OH)2↓+K2SO4 (2)第一次加入56gKOH溶液,发生反应后,滤出沉淀,再加入56gKOH溶液,又有沉淀生成,说明C烧杯中有CuSO4溶液剩余,D烧杯中只有一种溶质,则说明在C烧杯中恰好完全反应。设C烧杯中参加反应的硫酸铜质量为x。
2KOH+CuSO4===Cu(OH)2↓+K2SO4
160 98
x 4.9g
![]() =
=![]()
(3)设C烧杯中参加反应的KOH的质量是y。
2KOH+CuSO4===Cu(OH)2↓+K2SO4
2×56 98
y 4.9g
![]() =
=![]() ,解得y=5.6g
,解得y=5.6g
实验中两次都加入56gKOH溶液,所含溶质KOH的质量是2×5.6g=11.2g,设需要质量分数为20%的氢氧化钾溶液的质量为w。11.2g=w×20%,解得w=56g。
(4)设样品中硫酸铜的质量为z,第二次加入56gKOH溶液,恰好完全反应生成4.9沉淀,所以第一次加入56gKOH溶液也发生反应生成4.9g沉淀,滤出的8.9g不溶于水的物质中含有不溶于水的杂质,因此实验过程中一共生成了2×4.9g=9.8g沉淀。
2KOH+CuSO4===Cu(OH)2↓+K2SO4
160 98
z 9.8g
![]() =
=![]() ,解得z=16g
,解得z=16g
样品中硫酸铜的质量分数为:![]() ×100%=80%
×100%=80%
(5)D烧杯溶液中的溶质是K2SO4,设D烧杯溶液中溶质的质量为m。
2KOH+CuSO4===Cu(OH)2↓+K2SO4
98 174
9.8g m
![]() =
=![]() ,解得m=17.4g
,解得m=17.4g
D烧杯中溶液的质量为:81.8g+20g+56g-8.9g+56g-4.9g=200g
D烧杯中溶液的溶质质量为:![]() ×100%=8.7%
×100%=8.7%
(6)设若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为n。
Fe+ CuSO4 == Cu + FeSO4
160 64
n×80% 100kg×(1-4%)
![]() =
=![]() ,解得n=300kg
,解得n=300kg
-
科目: 来源: 题型:
查看答案和解析>>【题目】分类、类比、推理都是学习化学常用的方法。
(1)化学实验的设计除考虑实验目的外,还要考虑实验安全,减少对环境的污染等因素,据此应将下列实验中的A与_______(填“B”或“C”或“D”)归为一类,依据是__________。
硫在氧气中燃烧
铁丝在氧气中燃烧
一氧化碳还原氧化铁
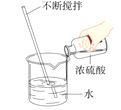
稀释浓硫酸
A
B
C
D
(2)汽车尾气已经成为许多大城市空气的主要污染源,汽车用燃料中含有碳元素,尾气中含有一氧化碳,其原因是_________(用文字叙述);汽车用燃料中不含氮元素,尾气中却含有一氧化氮,产生一氧化氮的原因是_________(用化学方程式表示,条件是“放电或高温”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室现有石灰石、稀盐酸、火柴、药匙、升降台、木条、棉花、镊子及以下仪器:

① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(1)若要制取二氧化碳,应选择的仪器有①锥形瓶和____(填序号),还需补充的仪器和用品是_________(填名称)
(2)若补充一种药品还能制取氧气,发生反应的化学方程式为_______。
(3)将制取氧气和检验氧气的装置图补充完整
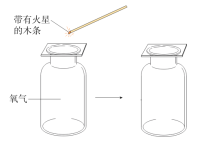
(4)用排水法收集氧气,当观察到导管口______时,开始收集,气体逸出的原因是由于试管内温度升高且______,使试管内压强_______,大于外界大气压,在压强差的作用下,气体逸出。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图中A、B、C、D、E、F分别表示初中化学常见的六种物质,B、C、D、E分别属于酸、碱、盐、氧化物四种类别中的一种,A是目前提取量最大的金属,B由两种元素组成,C是大理石的主要成分。(图中用“—”表示两种物质之间能发生化学反应,用“→”或“
 ”表示一种物质能转化为另一种物质,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)。
”表示一种物质能转化为另一种物质,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)。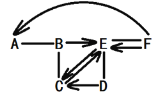
请回答下列问题。
(1)分别写出A、C、E、F物质的化学式 A______C_______E______F_______。
(2)写出B与C发生反应的化学方程式_______。
(3)写出过量A的粉末与B发生反应的实验现象_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有A、B、C、D、E五种常见物质,它们有如图所示的关系:

已知:C是一种金属,气体D可以使澄清石灰水变浑浊,E气体有毒,能与人体内的血红蛋白结合。
(1)写出图中五种物质的化学式:
A._____ B._____ C._____ D._____ E._____
(2)写出图中所示两个反应的化学方程式:_____;_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室开放日,某化学兴趣小组的同学在老师的指导下,设计了如下实验装置进行气体制取和性质的探究,请回答有关问题:
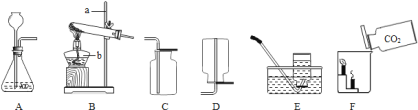
(1)请写出图中标有字母的仪器名称:a______b______.
(2)实验室用氯酸钾和二氧化锰混合制取氧气时,应选用的发生装置是______(填写装置的字母代号,下同),请写出该反应的化学方程式:__________,其中二氧化锰起______作用.
(3)实验室制取二氧化碳气体时,应选择的发生装置和收集装置是______.写出该反应的化学方程式__________________________。并写出用澄清石灰水检验二氧化碳时发生反应的化学方程式:_____________.
(4)如图F所示,向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳具有的性质是______、______且密度比空气的大,因此,二氧化碳可用于______.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学校化学学习小组同学设计出下图所示装置,并进行白磷燃烧实验。
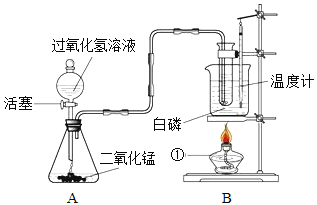
⑴当烧杯内的水受热,温度计显示30℃时,打开活塞,在盛有水的试管中有气泡均匀逸出,白磷未燃烧,关闭活塞。锥形瓶内反应的化学方程式是:___________________。白磷未燃烧的原因是___________。
⑵随着水温升高,温度计显示45℃时,再次打开活塞,白磷在水里燃烧。常言道,水火不相容。而本实验中白磷在水里还能够燃烧的原因是____________。
⑶本实验装置的A部分还可以用于制取的气体是______,收集该气体可选择_______的方法。
相关试题

