【题目】工业纯碱中常含有少量的氯化钠。某学习小组对其组成展开探究。现取24g纯碱样品,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀20g。完成下列问题:
(1)反应后溶液中含有的溶质是_____。(写化学式)。
(2)通过已知数据,能求出的量有_____(写字母序号)。
A.反应后溶液的总质量
B.参加反应的氯化钙的质量
C.样品中碳酸钠的质量分数
D.氯化钙溶液中溶质的质量分数
(3)计算反应后溶液中氯化钠的质量分数为_________。(写出计算过程,结果保留到0.1%)
参考答案:
【答案】 CaCl2、NaCl ABC 13.1%
【解析】(1)将24g的纯碱样品溶液水中后溶液中的溶质有碳酸钠和氯化钠,当加入过量的氯化钙后,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,故反应后溶液中的溶质有过量的氯化钙和生成的氯化钠,化学式为CaCl2、NaCl;
(2)生成的碳酸钙的质量是20g,故可以求出反应后溶液的总质量为24+100+96-20=200g,故A正确;碳酸钙的质量是20g,根据化学方程式可以求出参加反应的氯化钙的质量,故B正确;碳酸钙的质量是20g,根据化学方程式可以求出参加反应的碳酸钠的质量,故可以求出原样品中碳酸钠的质量分数,故C正确;由于氯化钙溶液是过量的,故不能求出氯化钙溶液的质量分数,故D错误。故选ABC。
(3)解:设反应后生成氯化钠的质量为x,参加反应的碳酸钠的质量为y,
Na2CO3+ CaCl2= CaCO3 ↓+2NaCl
106 100 117
y 20g x
![]() =
=![]() =
=![]() ,解得x=23.4g y=21.2g
,解得x=23.4g y=21.2g
故24g样品中氯化钠的质量为24g-21.2g=2.8g,故反应后溶液中氯化钠的质量为23.4g+2.8g=26.2g
反应后溶液的总质量为24+100+96-20=200g
反应后溶液中氯化钠的质量分数为![]() =13.1%
=13.1%
答;反应后溶液中氯化钠的质量分数为13.1%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程如下:
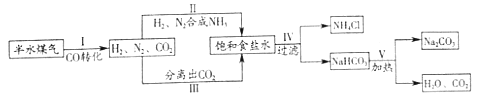
(1)流程中循环利用的物质有H2O和_____。
(2)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是_____。
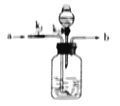
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶和分液瀾斗中盛放的药品分别是_____、_____。
(4)除去纯碱中少量碳酸氢钠杂质的方法是_____。
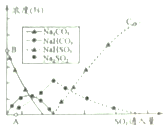
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图2所示。
①吸收初期(图中3A点以前)反应的化学方程式为_____。
②不断通入SO2,最终产物是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某课外研究小组,用废弃的黄铜(铜锌合金),通过两种途径制取硫酸铜晶体。实验流程如图所示:
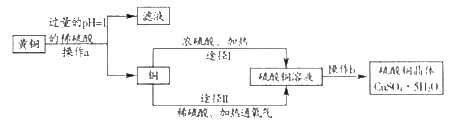
(1)操作a为_____,该操作中用到的玻璃仪器有烧杯、_____、玻璃棒。
(2)浓硫酸是化学实验室里一种常见的酸。
①实验室稀释浓硫酸的操作是:将_____,并用玻璃棒不断搅拌。
②化学实验应高度关注安全问题。若不慎将少量浓硫酸沾到皮肤上,应先用大量水冲洗,再涂_____溶液。
(3)如图是实验室用过氧化氢溶液和二氧化锰制取氧气的装置。
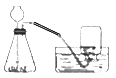
①主要实验操作步骤有:
a.收集气体 b.检查装置气密性 c.将二氧化锰放入锥形瓶中 d.从长颈漏斗中注入过氧化氢溶液
正确的操作顺序是_____(写字母序号)。
②在实验过程中,某同学因加入的药品量不足,致使集气瓶内剩余少量水。若想集满这瓶氧气,在不拆卸装置和不添加药品的前提下,请帮他想出种解决的方法_____。
(4)操作b的顺序为蒸发浓缩、_____ 过滤、干燥。
(5)下列测定稀硫酸pH的操作正确的是_____ (写字母序号)。
A.将pH试纸直接插入稀硫酸中
B.先将pH试纸用蒸馏水润湿
C.用玻璃棒蘸取少量稀硫酸,滴在pH试纸上
D.根据试纸显示的颜色估算出溶液的pH
-
科目: 来源: 题型:
查看答案和解析>>【题目】近五年来,我国在科技、文化、环境等方面创新发展。
I.大国重器航天、航空取得重大突破
2018年4月2日,天宫一号目标飞行器圆满完成各项任务返回大气层。这标志着我国航天航空事业进入了新时代。
(1)硅是天宫一号动力源太阳能电池的主要构成材料。单质硅是由石英(SiO2)固体与碳在高温条件下反应制得的,同时生成一种可燃性气体,该反应的化学方程式为_____。
(2)硅还是计算机芯片的基体材料,但其导热性不好,而金刚石在导热性方面远超过硅,于是它成了芯片基体材料的最佳选择。
①从原子结构上分析,金刚石(C)和硅有相似化学性质的原因是_____。
②因天然金刚石资源稀少,难以满足要求。人们就根据金刚石的组成和结构设法制造金刚石。现有两种制造金刚石的方法,一是以石墨为原料在高温高压和催化剂的条件下合成;二是在较低温度和压力下用甲烷(CH4)等为原料制造金刚石薄膜。
下列说法不正确的是_____(写字母序号)。
A.一种元素可以组成多种性质不同的单质
B.石墨合成金刚石发生的是物理变化
C.石墨与金刚石物理性质不同是因为结构不同
D.物质的性质在很大程度上决定了物质的用途,但不是唯一的决定因素
③不仅硅与碳具有相似化学性质,其氧化物二氧化硅和二氧化碳也有相似化学性质。试写出二氧化硅与氢氧化钠溶液反应的化学方程式_____。
Ⅱ.文化自信一传承中华优秀传统文化
古代我国人民就积累了许多对物质变化的认识。春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得溶液来洗涤丝帛。这种溶液能洗涤丝帛主要是因为其中一定含有_____(写化学式,水除外)。(注:草木灰的主要成分为碳酸钾,贝壳灰的主要成分为氧化钙)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某粗盐样品中除含有不溶性固体杂质外,可能还含有少量氯化镁、氯化钙、硫酸钠.某化学兴趣小组开展如下探究活动:
探究一:除去粗盐中不溶性杂质

探究二:从滤液1中提取氯化钠固体(该探究中,微溶物不沉淀)
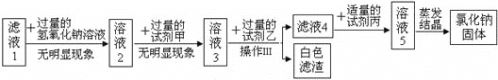
关于以上探究活动,有下列说法:
①试剂甲是碳酸钠溶液,试剂乙是氯化钡溶液 ②滤液1中的溶质一定有氯化钠,可能有氯化钙
③探究二所得的白色滤渣为碳酸钙 ④滤液4中加入适量的试剂丙时先产生气泡后出现白色沉淀
上述说法中正确的是( )
A. ①③ B. ② C. ②④ D. ①④
-
科目: 来源: 题型:
查看答案和解析>>【题目】氨气是一种密度比空气小、有刺激性气味的气体。加热条件下,氨气能将氧化铜还原成铜,反应的化学方程式为: 3CuO+2NH3
 3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法:
3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法: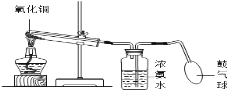
① 加热时试管口应略向下倾斜;② 反应中,可看到试管内有红色物质生成;③ 反应结束时,先撤导管,再灭酒精灯,以免液体倒流 ④ NH3没有毒,该装置不需对尾气进行处理。以上说法正确的是( )
A. ①② B. ①②③ C. ①②④ D. ①②③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙、丙三种物质的溶解度曲线。
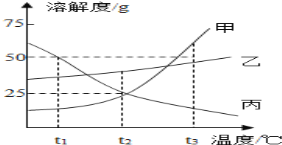
(1) 甲的溶解度为25g时的温度为_________。
(2) t3℃时,甲、乙各50g,分别加入到100g水中,充分搅拌。其中,不能形成饱和溶液的是_____。
(3) t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的结晶方式是____________
(4) 下列说法正确的是_________
A. 将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质的质量分数都不变
B. t2℃时,向100g甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%
C. t3℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲
D. 升高丙的饱和溶液的温度,一定有晶体析出
相关试题

