【题目】(7分)现欲探究一固体混合物A的成分,已知其中可能含有NH4Cl、Cu(OH)2、BaSO4、CaO、NH4 NO3五种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应均恰好完全反应)
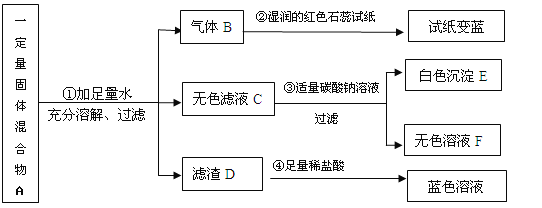
试根据实验过程和发生的现象判断:
(1)常温下,气体B的水溶液显_________(填“酸性”“中性”“碱性”之一)。
(2)滤渣D的化学式是_________________。
(3)固体混合物A中,一定存在的物质是(写化学式)___________________________。
(4)滤液C中,一定大量存在的金属离子是(写离子符号)________________________。
(5)写出过程③中可能发生的一个化学方程式: 。
(6)固体混合物A中还不能确定存在的物质是(写化学式) ,得出此结论的理由是 。
参考答案:
【答案】(1)碱性
(2)Cu(OH)2
(3)Cu(OH)2、CaO
(4)Ca2+
(5)Ca(NO3)2 + Na2CO3 =CaCO3↓ + 2 Na NO3
(6)NH4Cl、NH4NO3 理由:CaO一定存在,和水反应生成Ca(OH)2,NH4Cl、NH4NO3都含有NH4+,都可以和Ca(OH)2反应生成NH3,所以不能确定哪种物质存在
【解析】
试题分析:经过操作一可以得到气体说明其中一定含有铵盐和氧化钙,得到的气体是氨气具有碱性;因为氢氧化铜不能和铵盐反应;滤渣D和盐酸反应生成蓝色溶液说明混合物中一定含有氢氧化铜;加入碳酸钠会产生白色沉淀,说明白色沉淀是碳酸钙;固体混合物A中,一定存在的物质是氧化钙,氢氧化铜,滤液C中,一定大量存在的金属离子是钙离子;过程③中可能发生的一个反应是氯化钙或者是硝酸钙与碳酸钠的反应产生碳酸钙沉淀;固体混合物A中还不能确定存在的物质是两种铵盐,得出此结论的理由是NH4Cl、NH4NO3都含有NH4+,都可以和Ca(OH)2反应生成NH3,所以不能确定哪种物质存在。
-
科目: 来源: 题型:
查看答案和解析>>【题目】表示两个氧分子的是
A.O2 B.2O C.2O2 D.O2-
-
科目: 来源: 题型:
查看答案和解析>>【题目】鉴别日常生活中的下列各组物质,其操作不正确的是
A.生石灰(CaO)和熟石灰[Ca(OH)2]:加水
B.水和双氧水:加入少量二氧化锰
C.氮气和二氧化碳:伸入燃着的木条
D.食盐和白醋:滴加紫色石蕊试液
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如136C表示核内有6个质子和7个中子的碳原子。下列关于13153I和12753I的说法错误的是
A.各一个原子相比较,质子数相同 B.各一个原子相比较,中子数相同
C.各一个原子相比较,核外电子数相同 D.属于同种元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)溶解度是物质溶解性的定量表示,溶解度曲线可表示物质在不同温度下的溶解度。甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:
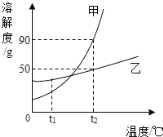
(1)甲、乙两种物质中溶解度受温度影响较大的是 物质。
(2)若甲物质中混有少量的乙物质,提纯甲物质最好采取的方法是 (填“降温结晶”或“蒸发结晶”)。
(3)t2℃时,乙物质的溶解度为 g;t2℃时,若将30g乙物质加入到50g水中,所得溶液的溶质质量分数是 (计算结果精确到0.1%)。
(4)将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,所得甲物质溶液的溶质质量分数 乙物质溶液的溶质质量分数(填“大于”“小于”“等于”之一)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于原子、分子叙述错误的是
A.分子都是由原子构成的 B.分子和原子都在不停运动
C.分子和原子在化学变化中都能够再分 D.分子和原子都是构成物质的微粒
-
科目: 来源: 题型:
查看答案和解析>>【题目】硝酸铜[Cu(NO3)2]广泛应用于烟花的生产。Cu(NO3)2固体受热分解时,放出一种有刺激性气味的气体,它可能是
A.SO2 B.NO2 C.NH3 D.N2
相关试题

