【题目】下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g 水)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
①20℃时溶解度较大的物质是_________ ;
②除去KNO3晶体中混有的少量 NaCl,通过溶解、蒸发浓缩、______、过滤、洗涤、干燥得到比较纯净的KNO3晶体。滤液中溶质的成分有___________。
③用 4 只小烧杯取 T℃时的水各 50 克,进行实验并记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
KNO3 质量/g | 40 | 50 | 60 | 70 |
H2O质量/g | 50 | 50 | 50 | 50 |
溶液质量/g | 90 | 100 | 105 | X |
Ⅰ.实验 1 所得溶液的质量分数为_______ ,实验 4 中 X 的值为 _________,
Ⅱ. T℃时KNO3 的溶解度是 _________ g/100g 水。
参考答案:
【答案】 NaCl 或氯化钠 冷却热饱和溶液 KNO3、NaCl 4/9 或 44.4% 105 110
【解析】根据所学知识和题中信息知,①20℃时溶解度较大的物质是氯化钠,溶解度是35.7g,硝酸钾溶解度是13.3g。②除去 KNO3 晶体中混有的少量 NaCl,通过溶解、蒸发浓缩、冷却热饱和溶液、过滤、洗涤、干燥得到比较纯净的 KNO3 晶体,氯化钠溶解度受温度影响变化不大,硝酸钾溶解度受温度影响变化较大。滤液中溶质的成分有KNO3、NaCl。③用 4 只小烧杯取 T℃时的水各 50 克,进行实验。Ⅰ.实验 1 所得溶液的质量分数为![]() ×100%=44.4%,实验 4 中 X 的值为105,硝酸钾55g已经饱和。Ⅱ. T℃时 KNO3 的溶解度是55g×2=110g。
×100%=44.4%,实验 4 中 X 的值为105,硝酸钾55g已经饱和。Ⅱ. T℃时 KNO3 的溶解度是55g×2=110g。
点睛∶可以用冷却热饱和溶液法提纯KNO3 晶体中混有的少量 NaCl,氯化钠溶解度受温度影响变化不大,硝酸钾溶解度受温度影响变化较大。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图相关信息回答下列问题。
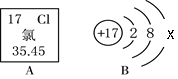
(1)氯元素属于______(填“金属”或“非金属”)元素。
(2)在氯原子结构示意图中,x =__________。
(3)氯离子在化学反应中__________电子变成氯原子。
(4)氯元素在周期表中应该排在第__________周期。
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。 下列说法正确的是

A. 反应前后分子总数不变
B. 反应中 X、Z 两种物质的质量比为 3:7
C. 反应中 Y 和 W 的物质的量之比为 4:5
D. 参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量
-
科目: 来源: 题型:
查看答案和解析>>【题目】2018 年世界环境日的主题是“人人参与,创建绿色家园”,我们需要:
①清新的空气。绿色植物光合作用产生_______ 气,使人类生生不息;口罩中填充活性炭是利用其_________ 性,以减少污染物的吸入;美丽的霓虹灯中填充的气体是__________。
②洁净的水源。天然水通过蒸发、沙滤、氧化等得到净化,其中蒸发属于_____ 变化(填”物理”或”化学”),自来水生产加入液氯的作用是________。水在通电条件下反应的化学方程式_________, 生成氢气和氧气的体积比是_________ ,0.5mol 水中约含 ________个氢原子。
③清洁的能源。化石燃料煤、石油、甲烷(CH4)中,写出甲烷燃烧的化学方程式_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】烧杯中有一些久置的氢氧化钠溶液 A,为确定其变质情况,进行如下实验。

(1)生成气体 B 的化学方程式______________。
(2)试剂 X 是______________(选填“硝酸钡”或“氢氧化钡”)溶液。
(3)若所加试剂 Y 是氯化铁溶液,则生成红褐色沉淀 E 的化学方程式______________ 。
(4)滤液 D 中溶质的成分有______________。
(5)结论:由方案 2 可知,烧杯中氢氧化钠溶液是______________(填“部分变质”或“完全变质”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用下图装置探究物质的性质(部分固定装置略)。

①仪器 a 的名称___________; 装置 A 中反应的化学方程式___________。
②装置 C 的作用___________;装置 D 中反应的化学方程式为___________ 。
③ 装置 E 中固体由黑色变成亮红色,反应化学方程式为___________;
④ 装置 F 是安全瓶,其作用是___________。
⑤把装置 A 中换成酒精灯,可用于氯酸钾与二氧化锰混合制取氧气。 试管中固体的质量随反应时间变化的数据见下表。
反应时间/min
0
t1
t2
t3
固体质量/g
26.0
20.2
16.4
16.4
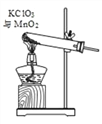
Ⅰ.共制得氧气的质量是_________g;
Ⅱ.参加反应的氯酸钾的物质的量是_________mol(通过化学方程式列式计算)。

-
科目: 来源: 题型:
查看答案和解析>>【题目】对稀硫酸的化学性质进行如下研究。
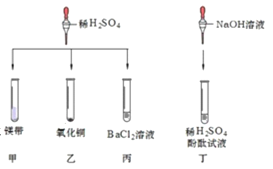
请回答下列问题:
①甲中观察到的现象是_____ ,反应的化学方程式为_________ ; 乙中反应的现象是 __________;
丙中反应的化学方程式为_____;丁中溶液由无色变成红色。
②当甲、乙试管内的固体完全溶解后,将两试管内的物质混合并加入过量的锌片、过滤,则滤渣的成分 是_________,滤液中溶质的化学式为___________。
③请设计能说明 NaOH 与H2SO4是否恰好中和的实验方案。(本题中所用过的试剂不能再用)
_______
实验步骤
实验现象
实验结论
_________
_________
_________
④实验结束后,将乙(其中固体全部溶解)、丁两个实验的废液倒入同一个干净的废液缸中,静置,最终看到上层清液呈红色,废液下层有沉淀。由此推断上层清液的成分有酚酞、水和_____。 写出生成下层沉淀物的化学方程式_____________。
通过上述实验可知,进行化学实验研究,除需要考虑生成什么物质外,还需要考虑_______。
相关试题

