【题目】实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系如下图所示。

回答下列问题:
(1)从图中看出生成沉淀的最大质量是 g。
(2)如图,当滴加碳酸钠溶液质量为10g时,溶液中的溶质是 (写化学式)。
(3)图中AB段表示的意义是 。
(4)计算实验所用碳酸钠溶液的溶质质量分数。
参考答案:
【答案】(1)5;(2)HCl、CaCl2、NaCl;(3)反应结束,碳酸钠溶液过量(或碳酸钠溶液过量);(4)53%
【解析】有图示可知,滴加碳酸钠溶液20g时开始出现沉淀,说明前20g碳酸钠溶液是与混合液中过量的盐酸反应,与盐酸完全反应后继续滴加碳酸钠溶液生成沉淀碳酸钙;
(1)从图中看出生成沉淀的最大质量是5g;
(2)如图,最初滴加的碳酸钠与过量的盐酸反应生成氯化钠和水、CO2,滴加碳酸钠溶液20g时才能将过量的盐酸完全反应掉,则当滴加碳酸钠溶液质量为10g时,溶液中的溶质为NaCl、HCl及CaCl2;
(3)图中AB段滴加碳酸钠溶液沉淀量不再增加,表示反应结束,碳酸钠溶液过量;
(4)由图示可知,滴加碳酸钠溶液10g生成5g碳酸钙沉淀,设10g碳酸钠溶液中碳酸钠的质量为x,
Na2CO3 + CaCl2 =CaCO3↓ +2NaCl
106 100
x 5g
![]() =
=![]() ,解得:x=5.3g,
,解得:x=5.3g,
则所用碳酸钠溶液的溶质质量分数为![]() ×100%=53%。
×100%=53%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习化学离不开实验。
【实验Ⅰ】下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:
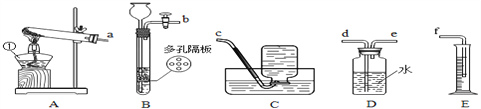
(1)写出图中编号仪器名称:①______。
(2)用高锰酸钾制取氧气时,所选用的发生装置还需添加的实验用品为______,反应的化学方程式为____________。若用D装置对氧气进行干燥,可将其中的水换成______。
(3)为了粗略测定加热一定质量的高锰酸钾所收集到氧气的体积,整套实验装置导管接口的正确连接顺序是__________(依次填导管接口,用a、b、c……表示);
(4)实验室若用装置B制取二氧化碳,多孔隔板上常放置的药品应为________(填名称),
【实验Ⅱ】实验室中,用98%的浓硫酸稀释成200g 20%的稀硫酸。请回答下列有关问题:
(1)实验仪器有胶头滴管、量筒、烧杯和__________。
(2)实验的主要步骤有计算、__________、配制、装瓶并贴标签。
请填写如下的标签:____________。

(3)用量筒量水仰视读数,所配溶液溶质质量分数_________20%。(填“大于”、“等于”或“小于”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】野炊结束后,同学们及时用沙土盖灭火堆,其主要灭火原理是
A. 将可燃物与氧气隔离 B. 降低可燃物的温度
C. 降低可燃物的着火点 D. 撤离可燃物
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图中的物质为初中化学常见物质,他们之间的反应关系如图所示(“→”表示转化关系,“﹣”表示相互能反应,部分反应物、生成物或反应条件已略去).人的胃液中含有少量的A可帮助消化,A、B发生中和反应,产物之一是厨房内常用的调味品;C常用于改良酸性土壤,D为碳酸盐,且C的溶液与D的溶液反应可得到B;F和G在常温下都为气体.请回答:

(1)A的化学式是_____;D的俗名是________.
(2)欲通过一步实验证明A、B是否恰好完全反应,需要向A、B反应后的溶液中加入的试剂是_________.
(3)E→C反应的化学方程式是____________.
G→F反应的化学方程式是______
(4)图中各物质相互转化中没有涉及的基本反应类型是 _________________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于图像的描述正确的是
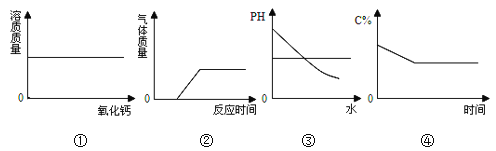
A. 图①表示室温下向饱和石灰水中加入一定量氧化钙,并恢复至室温
B. 图②表示把一片长时间暴露在空气中的铝箔投入到过量的稀盐酸中
C. 图③表示向氢氧化钠溶液中加入大量的水
D. 图④表示将饱和硝酸钾溶液恒温蒸发水份 (C%表示溶液的溶质质量分数)
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。流程简图如下,下列有关说法不正确的是
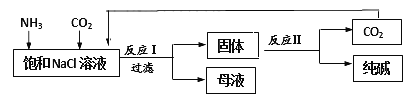
资料:已知铵盐均易溶于水,在受热的条件下均能分解。
A. 反应中为防止氨气逸出污染空气,应先通入二氧化碳
B. 反应I得到的另一物质在农业上可用作化肥
C. 反应II得到的CO2循环使用可以提高物质的利用率
D. 取过滤所得固体直接低温烘干后,加热至质量不再变化,固体质量减少6.2 g,则固体中NaHCO3的质量为16.8 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】粗盐提纯实验的部分操作如图所示,其中不正确的是
A. 取一定量粗盐
 B. 溶解
B. 溶解
C. 过滤
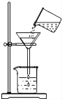 D. 蒸发
D. 蒸发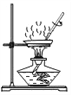
相关试题

